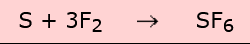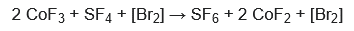Tiempo de lectura estimado: 8 minutos
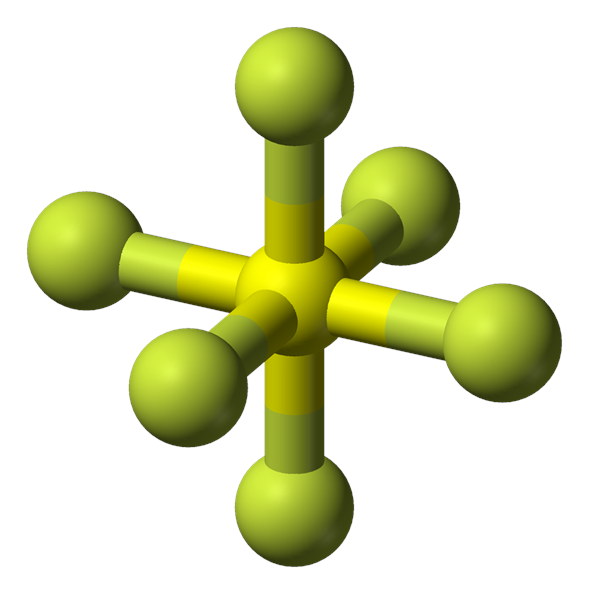
El hexafluoruro de azufre (SF6) es un gas de efecto invernadero extremadamente potente y persistente que se utiliza principalmente como aislante eléctrico y supresor de arcos. Es inorgánico, incoloro, inodoro, no inflamable y no tóxico. EL SF6 tiene una geometría octaédrica, formada por seis átomos de flúor unidos a un átomo de azufre central. Es una molécula hipervalente.
Típico de un gas no polar, el hexafluoruro de azufre es poco soluble en agua pero bastante soluble en disolventes orgánicos no polares. Tiene una densidad de 6,12 g/L en condiciones de nivel del mar, considerablemente mayor que la densidad del aire (1,225 g/L). Generalmente se transporta como gas comprimido licuado.
La concentración de hexafluoruro de azufre en la troposfera de la Tierra alcanzó las 10,63 partes por trillón (ppt) en 2021, aumentando a razón de 0,36 ppt/año. El aumento en los 40 años anteriores fue impulsado en gran parte por el sector de la energía eléctrica en expansión, incluyendo las emisiones fugitivas de los bancos de gas hexafluoruro de azufre contenidos en sus equipos de conmutación de media y alta tensión. Los usos en la fabricación de magnesio, aluminio y productos electrónicos también aceleraron el crecimiento atmosférico.
Historia del hexafluoruro de azufre
Fue reportado por primera vez en 1900 por Henri Moissan, el descubridor del flúor. Suele fabricarse quemando azufre en una atmósfera de flúor, aunque puede prepararse por pirólisis de SF5Cl (cuya síntesis no requiere el uso de flúor elemental).
El hexafluoruro de azufre debe purificarse rigurosamente antes de su uso, para eliminar los fluoruros reactivos; el lavado con un spray de KOH elimina el S2F2, el SO2F2 y el SF4, seguido de una pirólisis a 400°C, que convierte el S2F10 en una mezcla de SF4 y SF6. Este SF4 restante se elimina con un spray de KOH; a continuación, el SF6 se seca y se pasa por carbón vegetal para eliminar cualquier traza de impurezas. La pureza del SF6 se comprueba exponiendo a ratones albinos a una mezcla de 21% de oxígeno y 79% de SF6 durante 24 horas.
Es un gas incoloro, insípido, no inflamable, no tóxico e insoluble a temperatura ambiente. El SF6 está formado por moléculas de forma octaédrica, con una longitud de enlace de 1,561 Å (fase gaseosa); también existen el SeF6 y el TeF6, aunque éstos son más reactivos. Se conocen otros fluoruros octaédricos, pero todos contienen un metal, como en el UF6 y el PtF6. Al igual que otras sustancias covalentes, existen fuertes enlaces covalentes dentro de las moléculas, pero sólo fuerzas débiles (de Van der Waals) entre las moléculas, por lo que tiene un punto de ebullición y un punto de fusión bajos (en realidad sublima, a -63,7°C). Casi todos los hexafluoruros son muy reactivos; el SF6 es una excepción.
Alternativamente, utilizando bromo, el hexafluoruro de azufre puede sintetizarse a partir de SF4 y CoF3 a temperaturas más bajas (por ejemplo, 100 °C)
Prácticamente no hay química de reacción para el SF6. Una contribución principal a la inercia del hexafluoruro de azufre es el impedimento estérico del átomo de azufre, mientras que sus homólogos más pesados del grupo 16, como el SeF6, son más reactivos que el hexafluoruro de azufre como resultado de un menor impedimento estérico. No reacciona con el sodio fundido por debajo de su punto de ebullición, pero reacciona exotérmicamente con el litio.
Aplicaciones
La industria de la energía eléctrica utilizó alrededor del 80% del hexafluoruro de azufre producido en el año 2000, principalmente como medio dieléctrico gaseoso. Otros usos principales a partir de 2015 fueron como grabador de silicio para la fabricación de semiconductores y gas inerte para la fundición de magnesio.
Medio dieléctrico
El hexafluoruro de azufre se utiliza en la industria eléctrica como medio dieléctrico gaseoso para los disyuntores de hexafluoruro de azufre de alta tensión, los equipos de conmutación y otros equipos eléctricos, sustituyendo a menudo a los disyuntores llenos de aceite (OCB) que pueden contener los dañinos bifenilos policlorados (PCB). El SF6 a presión se utiliza como aislante en los equipos de conmutación aislados por gas (GIS) porque tiene una resistencia dieléctrica mucho mayor que el aire o el nitrógeno seco. La alta rigidez dieléctrica es el resultado de la alta electronegatividad y densidad del gas. Esta propiedad permite reducir considerablemente el tamaño de los equipos eléctricos. Esto hace que los GIS sean más adecuados para determinados fines, como la colocación en interiores, a diferencia de los equipos eléctricos aislados por aire, que ocupan mucho más espacio.
Los equipos eléctricos aislados por gas también son más resistentes a los efectos de la contaminación y el clima, además de ser más fiables en su funcionamiento a largo plazo debido a su entorno operativo controlado. La exposición a un arco eléctrico descompone químicamente el hexafluoruro de azufre, aunque la mayoría de los productos de descomposición tienden a volver a formar rápidamente SF 6, un proceso denominado «autocuración». El arco o la corona pueden producir decafluoruro de azufre (S2F10), un gas altamente tóxico, con una toxicidad similar a la del fosgeno.
El decafluoruro de azufre fue considerado un potencial agente químico de guerra en la Segunda Guerra Mundial porque no produce lagrimeo ni irritación de la piel, por lo que apenas avisa de la exposición. El hexafloururo también se encuentra habitualmente como dieléctrico de alta tensión en los suministros de alta tensión de los aceleradores de partículas, como los generadores Van de Graaff y los Pelletrones y los microscopios electrónicos de transmisión de alta tensión.
Las alternativas al hexafluoruro de azufre como gas dieléctrico incluyen varias fluorocetonas. Se ha introducido la tecnología GIS compacta que combina la conmutación en vacío con el aislamiento de aire limpio para un subconjunto de aplicaciones de hasta 420 kV.
Uso medico
El hexafluoruro de azufre se utiliza para taponar o taponar un agujero de la retina en las operaciones de reparación de desprendimientos de retina en forma de burbuja de gas. Es inerte en la cámara vítrea e inicialmente duplica su volumen en 36 horas antes de ser absorbido por la sangre en 10-14 días.
El hexafluoruro de azufre se utiliza como agente de contraste para la obtención de imágenes por ultrasonidos. Las microburbujas de hexafluoruro de azufre se administran en solución mediante una inyección en una vena periférica. Estas microburbujas aumentan la visibilidad de los vasos sanguíneos a los ultrasonidos. Esta aplicación se ha utilizado para examinar la vascularidad de los tumores. Permanece visible en la sangre de 3 a 8 minutos y es exhalada por los pulmones.
Compuesto trazador
El hexafluoruro de azufre fue el gas trazador utilizado en la primera calibración de un modelo de dispersión del aire en carretera; este programa de investigación fue patrocinado por la Agencia de Protección Ambiental de los Estados Unidos y se llevó a cabo en Sunnyvale, California, en la autopista 101. El hexafluoruro de azufre gaseoso se utiliza como gas trazador en experimentos a corto plazo sobre la eficiencia de la ventilación en edificios y recintos interiores, y para determinar las tasas de infiltración. Dos factores importantes recomiendan su uso: su concentración puede medirse con una precisión satisfactoria en concentraciones muy bajas, y la atmósfera terrestre tiene una concentración insignificante de hexafluoruro.
El hexafluoruro de azufre se utilizó como gas de prueba no tóxico en un experimento realizado en la estación de metro de St John’s Wood (Londres, Reino Unido) el 25 de marzo de 2007. El objetivo del experimento, que había sido anunciado anteriormente en marzo por el secretario de Estado de Transportes, Douglas Alexander, era investigar cómo podría propagarse un gas tóxico por las estaciones y edificios del metro de Londres durante un ataque terrorista.
El hexafluoruro de azufre también se utiliza habitualmente como gas trazador en las pruebas de contención de las campanas de gases de los laboratorios. El gas se utiliza en la fase final de la calificación de las campanas de extracción ASHRAE 110. Se genera un penacho de gas en el interior de la campana de humos y se realiza una serie de pruebas mientras un analizador de gases dispuesto fuera de la campana toma muestras de hexafluoruro de azufre para verificar las propiedades de contención de la campana de humos.
Se ha utilizado con éxito como trazador en oceanografía para estudiar la mezcla diapical y el intercambio de gases aire-mar.
Para más información Sulfur Hexafluoride (SF6) Basics
Como citar este artículo:
APA: (2022-10-11). Hexafluoruro de azufre. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/hexafluoruro-de-azufre/
ACS: . Hexafluoruro de azufre. https://quimicafacil.net/compuesto-de-la-semana/hexafluoruro-de-azufre/. Fecha de consulta 2026-01-29.
IEEE: , "Hexafluoruro de azufre," https://quimicafacil.net/compuesto-de-la-semana/hexafluoruro-de-azufre/, fecha de consulta 2026-01-29.
Vancouver: . Hexafluoruro de azufre. [Internet]. 2022-10-11 [citado 2026-01-29]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/hexafluoruro-de-azufre/.
MLA: . "Hexafluoruro de azufre." https://quimicafacil.net/compuesto-de-la-semana/hexafluoruro-de-azufre/. 2022-10-11. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net