Tiempo de lectura estimado: 6 minutos
El fluoruro de hidrógeno es un compuesto químico con la fórmula química HF. Este gas o líquido incoloro es la principal fuente industrial de flúor, a menudo en forma de solución acuosa llamada ácido fluorhídrico.
Es una importante materia prima en la preparación de muchos compuestos importantes, incluidos los productos farmacéuticos y los polímeros (por ejemplo, el teflón). El HF se utiliza ampliamente en la industria petroquímica como componente de los superácidos.
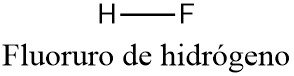
El fluoruro de hidrógeno hierve cerca de la temperatura ambiente, mucho más alto que otros halogenuros de hidrógeno.
El fluoruro de hidrógeno es un gas muy peligroso, que forma ácido fluorhídrico corrosivo y penetra en él al entrar en contacto con la humedad. El gas también puede causar ceguera por la rápida destrucción de las córneas.
En 1771 Carl Wilhelm Scheele preparó la solución acuosa, el ácido fluorhídrico en grandes cantidades, aunque el ácido fluorhídrico ya se conocía en la industria del vidrio. Se atribuye al químico francés Edmond Frémy (1814-1894) el descubrimiento del fluoruro de hidrógeno anhidro (HF) al tratar de aislar el flúor.
Química del fluoruro de hidrogeno
Aunque es una molécula diatómica, el HF forma enlaces de hidrógeno intermoleculares relativamente fuertes. El HF sólido consiste en cadenas en zig-zag de moléculas de HF. Las moléculas de HF, con un corto enlace H-F de 95 pm, están unidas a las moléculas vecinas por distancias intermoleculares H-F de 155 pm. El fluoruro de hidrogeno líquido también consiste en cadenas de moléculas de HF, pero las cadenas son más cortas, consistiendo en promedio de sólo cinco o seis moléculas.
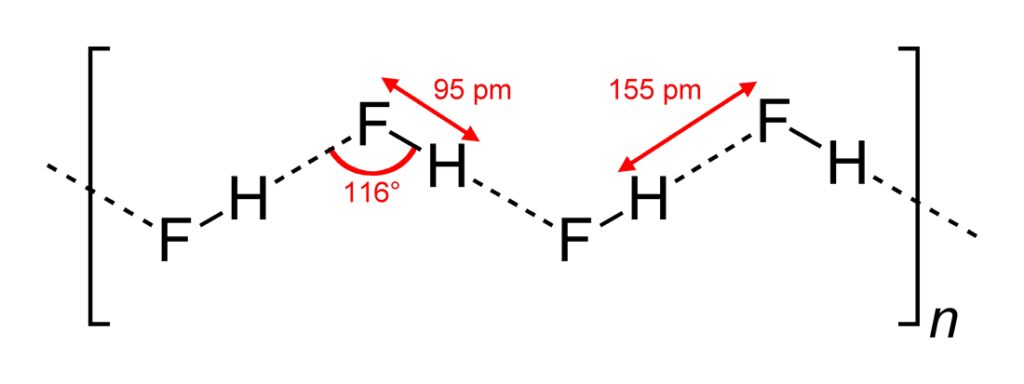
El fluoruro de hidrógeno no hierve hasta los 20 °C, en contraste con los haluros de hidrógeno más pesados, que hierven entre los -85 °C y los -35 °C. Esta unión de hidrógeno entre las moléculas de HF da lugar a una alta viscosidad en la fase líquida y a una presión inferior a la esperada en la fase gaseosa.
Soluciones de fluoruro de hidrogeno
El fluoruro de hidrogeno es miscible con el agua (se disuelve en cualquier proporción). Por el contrario, los otros haluros de hidrógeno presentan solubilidades limitantes en el agua. El fluoruro de hidrógeno forma un monohidrato HF.H2O (-40 °C (-40 °F), que está a 44 °C (79 °F) por encima del punto de fusión del HF puro.

Las soluciones acuosas de HF se llaman ácido fluorhídrico. Cuando se diluye, el ácido fluorhídrico se comporta como un ácido débil, a diferencia de los otros ácidos hidroálicos, debido a la formación de pares de iones ligados al hidrógeno [H3O+-F–]. Sin embargo, las soluciones concentradas son ácidos fuertes, porque los aniones bifluoruro son predominantes, en lugar de los pares de iones. En el HF anhidro líquido, se produce la auto-ionización:
que forma una solución extremadamente ácida (H0 = -11).
El HF reacciona con los ácidos de Lewis para dar superácidos. Una función de acidez de Hammett (H0) de -21 se obtiene con el pentafluoruro de antimonio (SbF5).
Síntesis y producción de fluoruro de hidrógeno
El fluoruro de hidrógeno se produce a partir de la fluorita (CaF2). El mineral está ampliamente distribuido en depósitos explotables en todo el mundo, particularmente en China, México, África del Sur y Rusia. La producción mundial anual de fluorita supera los 4 millones de toneladas.
La fluorita (20-80% de fluoruro de calcio) se concentra con una pureza del 98% mediante técnicas de flotación para obtener material de «grado ácido». La sílice es la principal impureza que se elimina.
La fluorita de grado ácido se mezcla con ácido sulfúrico concentrado precalentado y la mezcla resultante se introduce continuamente en grandes hornos rotativos. La mezcla de fluorita y ácido sulfúrico se calienta a 600 K durante varias horas.
Los gases, principalmente el fluoruro de hidrógeno, emergen del extremo del horno horizontal, y son destilados fraccionadamente en una columna, llamada prelavadora. Se eliminan los sólidos y el ácido sulfúrico y el vapor de fluoruro de hidrógeno se purifica hasta alcanzar una pureza superior al 99,9% mediante la destilación en recipientes de cobre o acero, se condensa y se almacena en contenedores de acero.
El efluente gaseoso es en gran parte tetrafluoruro de silicio, que al reaccionar con el agua produce ácido fluorosilícico, H2SiF6.
El ácido fluorosilícico es un subproducto importante de éste y de la fabricación de ácido fosfórico. Puede ser neutralizado con hidróxido de sodio para formar hexafluorosilicato de sodio, usado para fluorizar el agua potable. El ácido también se utiliza para fabricar fluoruro de aluminio, que a su vez se utiliza en la fabricación de aluminio.
El sulfato de calcio, generado en la fabricación de fluoruro de hidrógeno, se conoce como anhidrita sintética o fluoroanhidrita. La anhidrita sintética se utiliza actualmente en diversas aplicaciones, entre ellas la fabricación de bloques de construcción de hormigón celular y algunos cementos.
El otro uso principal del fluoruro de calcio es la producción de hierro, acero y otros metales. La fluorita de grado metalúrgico se utiliza como fundente para reducir el punto de fusión de las materias primas y para disminuir la viscosidad de la escoria, lo que facilita la eliminación de las impurezas.
Riesgos
Al entrar en contacto con la humedad, incluidos los tejidos, el fluoruro de hidrógeno se convierte inmediatamente en ácido fluorhídrico, que es muy corrosivo y tóxico. La exposición requiere atención médica inmediata.
Puede causar ceguera por la rápida destrucción de las córneas. La inhalación de fluoruro de hidrógeno en altos niveles o en combinación con el contacto con la piel puede causar la muerte por la irregularidad de los latidos del corazón o por la acumulación de líquido en los pulmones.
Para más información Hydrogen fluoride
Como citar este artículo:
APA: (2020-10-06). Fluoruro de hidrógeno. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/fluoruro-de-hidrogeno/
ACS: . Fluoruro de hidrógeno. https://quimicafacil.net/compuesto-de-la-semana/fluoruro-de-hidrogeno/. Fecha de consulta 2026-02-14.
IEEE: , "Fluoruro de hidrógeno," https://quimicafacil.net/compuesto-de-la-semana/fluoruro-de-hidrogeno/, fecha de consulta 2026-02-14.
Vancouver: . Fluoruro de hidrógeno. [Internet]. 2020-10-06 [citado 2026-02-14]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/fluoruro-de-hidrogeno/.
MLA: . "Fluoruro de hidrógeno." https://quimicafacil.net/compuesto-de-la-semana/fluoruro-de-hidrogeno/. 2020-10-06. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net