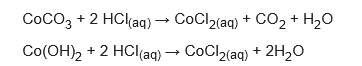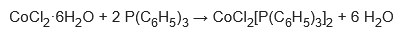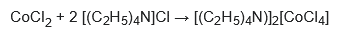Tiempo de lectura estimado: 7 minutos
El cloruro de cobalto(II) es un compuesto inorgánico de cobalto y cloro, con la fórmula CoCl2. El compuesto forma varios hidratos CoCl2·nH2O, para n = 1, 2, 6 y 9. No se han confirmado la formación de tri- y tetrahidratos.
La forma anhidra es un sólido cristalino azul; el dihidrato es púrpura y el hexahidrato es rosa. Las muestras comerciales suelen ser el hexahidrato, que es una de las sales de cobalto más comúnmente utilizadas en el laboratorio.
Síntesis del cloruro de cobalto(II)
El cloruro de cobalto se puede preparar en solución acuosa a partir de hidróxido de cobalto(II) o carbonato de cobalto(II) y ácido clorhídrico:
El dihidrato sólido y el hexahidrato se pueden obtener por evaporación. Enfriar soluciones acuosas saturadas produce el dihidrato entre 120.2 °C y 51.25 °C, y el hexahidrato por debajo de 51.25 °C. El hielo, en lugar de cloruro de cobalto, cristalizará a partir de soluciones con una concentración inferior al 29%. El monohidrato y las formas anhidras se pueden obtener enfriando las soluciones solo bajo alta presión, por encima de 206 °C y 335 °C, respectivamente.
El compuesto anhidro se puede preparar calentando los hidratos.
Si se hace un calentamiento rápido o en un recipiente cerrado, cada uno de los hidratos 6-, 2- y 1- se funde parcialmente en una mezcla del hidrato inferior siguiente y una solución saturada, a 51.25 °C, 206 °C y 335 °C, respectivamente.
El calentamiento lento en un recipiente abierto, de modo que la presión de vapor de agua sobre el sólido sea prácticamente cero, hace que el agua se evapore de cada uno de los sólidos 6-, 2- y 1- hidratos, dejando el hidrato inferior siguiente, a unos 40°C, 89°C y 125°C, respectivamente. Si la presión parcial del vapor de agua está en equilibrio con el sólido, como en un recipiente confinado, pero no presurizado, la descomposición ocurre a unos 115°C, 145°C y 195°C, respectivamente.
La deshidratación también puede efectuarse con cloruro de trimetilsililo
El compuesto anhidro puede purificarse por sublimación al vacío.
Usos del cloruro de cobalto(II)
En el laboratorio, el cloruro de cobalto(II) sirve como precursor común para otros compuestos de cobalto. Generalmente, soluciones acuosas diluidas de la sal se comportan como otras sales de cobalto(II) ya que estas soluciones consisten en el ion [Co(H2O)6]2+ independientemente del anión. Por ejemplo, tales soluciones producen un precipitado de sulfuro de cobalto (CoS) al tratarse con sulfuro de hidrógeno (H2S).
Cloruros complejos
El hexahidrato y la sal anhidra son ácidos de Lewis débiles. Los aductos suelen ser octaédricos o tetraédricos. Forma un complejo octaédrico con piridina (C5H5N):
Con trifenilfosfina (P(C6H5)3), resulta un complejo tetraédrico:
Las sales del complejo aniónico CoCl42− se pueden preparar utilizando cloruro de tetraetilamonio:
Reducción
La reacción del compuesto anhidro con ciclopentadienuro de sodio produce cobaltoceno Co(C5H5)2. Esta especie de 19 electrones es un buen agente reductor, ya que se oxida fácilmente al catión cobaltocenio de 18 electrones de color amarillo [Co(C5H5)2]+.


Oxidación a cobalto(III)
Existen compuestos de cobalto en el estado de oxidación +3, como el fluoruro de cobalto(III) CoF3, nitrato de cobalto(III) Co(NO3)3 y sulfato de cobalto(III) Co2(SO4)3; sin embargo, el cloruro de cobalto(III) CoCl3 no es estable en condiciones normales y se descompondría inmediatamente en CoCl2 y cloro.
Por otro lado, se pueden obtener cloruros de cobalto(III) si el cobalto está también unido a otros ligandos de mayor basicidad de Lewis que el cloruro, como aminas. Por ejemplo, en presencia de amoníaco, el cloruro de cobalto(II) se oxida fácilmente por el oxígeno atmosférico para formar cloruro de hexamincobalto(III):
Ocurren reacciones similares con otras aminas. Estas reacciones a menudo se realizan en presencia de carbón como catalizador o con peróxido de hidrógeno H2O2 en lugar de oxígeno atmosférico. Otros ligandos altamente básicos, como carbonato, acetilacetona y oxalato, inducen la formación de derivados de Co(III). Los carboxilatos simples y los haluros no lo hacen.
A diferencia de los complejos de Co(II), los complejos de Co(III) intercambian ligandos muy lentamente, por lo que se dice que son cinéticamente inertes. El químico alemán Alfred Werner recibió el premio Nobel en 1913 por sus estudios sobre una serie de estos compuestos de cobalto(III), trabajos que llevaron a comprender las estructuras de tales compuestos de coordinación.
Oxidación a cobalto(IV)
La reacción de 1-norbornillitio con CoCl2·THF en pentano produce el tetrakis(1-norbornilo)cobalto(IV) de color marrón y termoestable, un raro ejemplo de un compuesto estable de metal de transición/alcano saturado, se obtienen productos diferentes en otros disolventes.
Indicador de humedad
El cloruro de cobalto es un indicador visual común de humedad debido a su cambio de color distintivo cuando está hidratado. El cambio de color va desde algún tono de azul cuando está seco hasta rosa cuando está hidratado, aunque la tonalidad del color depende del sustrato y la concentración.

Se impregna en papel para hacer tiras de prueba para detectar la humedad en soluciones, o más lentamente, en el aire/gases. Los desecantes como el gel de sílice pueden incorporar cloruro de cobalto para indicar cuándo está «agotado» (es decir, hidratado).
Otros usos del cloruro de cobalto(II)
Tinta invisible: cuando se suspende en una solución, el cloruro de cobalto(II) puede hacerse invisible en una superficie; cuando esa misma superficie se expone posteriormente a un calor significativo (como el de una pistola de calor o un encendedor manual), la tinta cambia de manera reversible a azul.
El cloruro de cobalto es un inductor químico establecido de respuestas similares a la hipoxia, como la eritropoyesis. La suplementación con cobalto no está prohibida y, por lo tanto, no se detectaría mediante las pruebas actuales antidopaje. El cloruro de cobalto es una sustancia prohibida bajo la Junta de Carreras de Purasangre de Australia.
El cloruro de cobalto es un método utilizado para inducir la hipertensión arterial pulmonar en animales con fines de investigación y evaluación de la eficacia del tratamiento.
Para más información Cobalt chloride (CoCl2)
Como citar este artículo:
APA: (2024-10-08). Cloruro de cobalto(II). Recuperado de https://quimicafacil.net/compuesto-de-la-semana/cloruro-de-cobaltoii/
ACS: . Cloruro de cobalto(II). https://quimicafacil.net/compuesto-de-la-semana/cloruro-de-cobaltoii/. Fecha de consulta 2026-02-14.
IEEE: , "Cloruro de cobalto(II)," https://quimicafacil.net/compuesto-de-la-semana/cloruro-de-cobaltoii/, fecha de consulta 2026-02-14.
Vancouver: . Cloruro de cobalto(II). [Internet]. 2024-10-08 [citado 2026-02-14]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/cloruro-de-cobaltoii/.
MLA: . "Cloruro de cobalto(II)." https://quimicafacil.net/compuesto-de-la-semana/cloruro-de-cobaltoii/. 2024-10-08. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net