Tiempo de lectura estimado: 7 minutos
Captopril, vendido bajo el nombre comercial de Capoten entre otros, es un inhibidor de la enzima convertidora de angiotensina (ACE) utilizado para el tratamiento de la hipertensión y algunos tipos de insuficiencia cardíaca congestiva. Captopril fue el primer inhibidor de ACE oral encontrado para el tratamiento de la hipertensión.
No causa fatiga como se asocia con los betabloqueantes. Debido al evento adverso de causar hiperpotasemia, como se ve con la mayoría de los inhibidores de ACE, el medicamento suele combinarse con un diurético.
Captopril fue patentado en 1976 y aprobado para uso médico en 1980.
Historia del Captopril
En 1939, un farmacólogo brasileño llamado Dr. Maurício Rocha e Silva, que trabajaba en el Instituto Biológico de São Paulo, Brasil, comenzó un estudio sobre el shock circulatorio y las enzimas relacionadas con la toxicología de las mordeduras de serpientes.
Inyectó veneno de diferentes serpientes venenosas en animales de prueba y observó qué enzimas o sustancias químicas se producían en el cuerpo del animal como resultado. En 1948, junto con sus colegas Wilson Teixeira Beraldo y Gastão Rosenfeld, el grupo estaba estudiando los componentes del plasma sanguíneo de animales que habían sido inyectados con veneno de la serpiente de cabeza de lanza brasileña (Bothrops jararaca), o víbora de foso.
Este veneno es tan poderoso que es utilizado por las tribus indígenas brasileñas como veneno para flechas. En el plasma sanguíneo del animal, los investigadores encontraron un nuevo péptido al que llamaron bradiquinina, que recibió su nombre en función de las observaciones del efecto del veneno de serpiente en el músculo liso intestinal, que se notó que se contraía lentamente (bradi es griego para ‘lento’, y kinin es griego para ‘mover’).
Bradiquinina
Los científicos brasileños también descubrieron que la bradiquinina causa la dilatación (ensanchamiento) de los vasos sanguíneos y, por lo tanto, provoca una disminución de la presión arterial.
Unos años después, el Dr. Sérgio Ferreira de la Universidad de São Paulo descubrió otra molécula en el veneno de serpiente que aumentaba de manera poderosa tanto la duración como la magnitud de sus efectos en la vasodilatación y la consiguiente disminución de la presión arterial. Llamó a esta molécula factor potenciador de la bradiquinina (BPF), y esto dio la idea para una nueva gama de medicamentos para tratar la hipertensión arterial.
La bradiquinina es una cadena de péptidos de 9 aminoácidos, con la secuencia Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg. En el cuerpo humano, la bradiquinina se descompone rápidamente por tres cinasas (enzimas), la enzima convertidora de angiotensina (ACE), la aminopeptidasa P (APP) y la carboxipeptidasa N (CPN), que cortan la molécula en las posiciones 7-8, 1-2 y 8-9, respectivamente.
Estas cinasas se producen de forma natural en los pulmones y los riñones, circulan en el torrente sanguíneo y actúan para mantener los niveles de líquido en el cuerpo (por ejemplo, en el plasma sanguíneo, la linfa y el líquido intersticial) constantes.
Por lo tanto, darle a alguien BPF no sería muy efectivo, ya que estas cinasas lo descompondrían rápidamente. Sin embargo, los inhibidores de la enzima convertidora de angiotensina (ACE) son capaces de aumentar los niveles de bradiquinina en el cuerpo, lo que puede contribuir a la reducción de la presión arterial en pacientes con hipertensión arterial.
Royal College of Surgeons
En 1967, Kevin K.F. Ng estaba estudiando dos moléculas que se encontraban en el torrente sanguíneo humano y que parecían controlar la presión arterial en el Royal College of Surgeons de Inglaterra, en Londres. Cuando los riñones detectan una disminución de la presión arterial, células especiales producen una molécula llamada renina, que a través de una serie de reacciones produce dos moléculas más llamadas angiotensina I y angiotensina II.
La importante resultó ser la angiotensina II, que hace que las paredes de los vasos sanguíneos se contraigan, aumentando la presión arterial. Trabajando juntos, los grupos de Londres y Brasil se dieron cuenta de que la misma enzima que convertía la angiotensina I en angiotensina II también era responsable de la inactivación de la bradiquinina y del BPF. Si pudieran identificar esta enzima, podrían inhibirla y permitir que se regulase la presión arterial.
Inhibidores de la ECA
La principal enzima a la que se dirigían los fabricantes de medicamentos era la enzima convertidora de angiotensina (ECA), por lo que los fármacos que frenan esta enzima se denominan inhibidores de la ECA.
A partir de los estudios del veneno de serpiente, los investigadores encontraron que una variación particular de la bradiquinina, un péptido de nueve aminoácidos llamado teprotida, parecía ser la más prometedora porque reducía eficazmente la presión arterial y parecía tener un efecto duradero. Sin embargo, era costosa y no se podía administrar por vía oral.
Al modificar sistemáticamente la estructura de la teprotida y observar qué efecto tenía esto en su actividad, Miguel Ondetti, Bernard Rubin y David Cushman en la compañía farmacéutica estadounidense Squibb (ahora Bristol-Myers Squibb) identificaron las partes de la molécula que eran necesarias para que funcionara. Resultó que la parte activa era el grupo prolinado al final, que se muestra en azul en la estructura a continuación. El resto de la molécula ayudó a unirlo al sitio activo en la enzima ACE.
Modificando la teprotida
Lo que se necesitaba ahora era tomar el grupo prolinado y agregar una cadena lateral diferente que se uniera de manera más efectiva a la enzima que el grupo original de 8 aminoácidos. Pero de todas las posibles moléculas orgánicas que podrían elegir, ¿dónde comenzar?
Alrededor de esta época, se publicó un artículo de investigadores que estaban estudiando la actividad de otra enzima, la carboxipeptidasa A, que mostraba que la molécula ácido L-bencil succínico inhibía esta enzima al unirse fuertemente a ella.
Por lo tanto, el siguiente paso lógico fue diseñar una molécula que combinara la capacidad de unión a la enzima del ácido L-bencil succínico con la actividad de inhibición de la ACE del prolinado, lo que resultó en la succinil-L-prolina. Se descubrió que esta nueva molécula tenía una actividad aumentada. Sin embargo, la actividad aún no era lo suficientemente alta como para que fuera un medicamento efectivo, por lo que comenzó la búsqueda de un grupo de unión a la enzima mejor.
La sustitución del grupo carboxilo succinilo por funcionalidades que contienen nitrógeno (amina, amida o guanidina) no funcionó. Sin embargo, la sustitución del grupo carboxilo por una función sulfhidrilo (SH) produjo un inhibidor potente que fue 1000 veces más activo que la succinil-L-prolina.
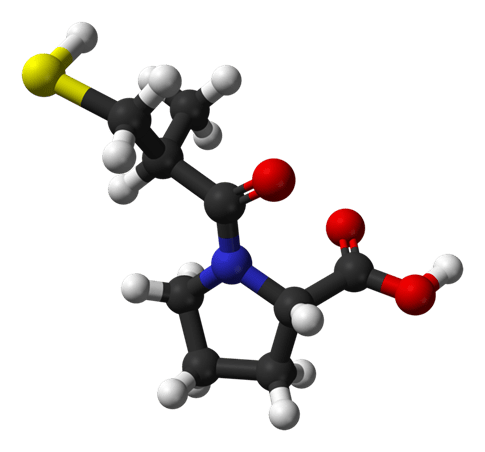
El siguiente paso fue optimizar la longitud de la cadena acilo. Se descubrió que la longitud óptima de la cadena acilo era tres, es decir, 3-mercaptopropanoil-L-prolina, lo que produjo una actividad cinco veces mayor que la de los derivados de 2-mercaptoalcanoilo y 50 veces mayor que la de los derivados de 4-mercaptoalcanoilo. La adición de un grupo metilo en la posición 2 también aumentó la potencia, por lo que se encontró que el ácido (2S)-1-[(2S)-2-metil-3-sulfanilpropanoil]pirrolidina-2-carboxílico era el inhibidor más potente, y esto se convirtió en el fármaco comercializado como Captopril por la compañía Bristol-Myers Squibb.
El captopril obtuvo la aprobación de la FDA el 6 de abril de 1981 y ahora es un fármaco comúnmente recetado para tratar la hipertensión. Sin embargo, tiene algunos efectos secundarios adversos, particularmente tos, erupciones y trastornos del gusto. Como resultado, se han desarrollado otros fármacos inhibidores de la ACE basados en la estructura del Captopril, que reducen estos efectos. Estos incluyen enalapril, lisinopril y ramipril.
Para más información Captopril
Como citar este artículo:
APA: (2023-10-31). Captopril. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/captopril/
ACS: . Captopril. https://quimicafacil.net/compuesto-de-la-semana/captopril/. Fecha de consulta 2026-02-17.
IEEE: , "Captopril," https://quimicafacil.net/compuesto-de-la-semana/captopril/, fecha de consulta 2026-02-17.
Vancouver: . Captopril. [Internet]. 2023-10-31 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/captopril/.
MLA: . "Captopril." https://quimicafacil.net/compuesto-de-la-semana/captopril/. 2023-10-31. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net