Tiempo de lectura estimado: 8 minutos
La cristalización es el proceso por el que se forma un sólido, en el que los átomos o las moléculas están muy organizados en una estructura conocida como cristal.
Algunas de las formas en que se forman los cristales son la precipitación a partir de una solución, la congelación o, más raramente, la deposición directa a partir de un gas. Los atributos del cristal resultante dependen en gran medida de factores como la temperatura, la presión atmosférica y, en el caso de los cristales líquidos, el tiempo de evaporación del fluido.
La cristalización se produce en dos etapas principales. La primera es la nucleación, la aparición de una fase cristalina a partir de un líquido sobreenfriado o de un disolvente sobresaturado.
El segundo paso se conoce como crecimiento del cristal, que es el aumento del tamaño de las partículas y conduce a un estado cristalino. Una característica importante de este paso es que las partículas sueltas forman capas en la superficie del cristal y se alojan en inconsistencias abiertas como poros, grietas, etc.
Cristalización en química
La mayoría de los minerales y moléculas orgánicas cristalizan con facilidad, y los cristales resultantes suelen ser de buena calidad, es decir, sin defectos visibles. Sin embargo, las partículas bioquímicas más grandes, como las proteínas, suelen ser difíciles de cristalizar.
La facilidad de cristalización de las moléculas depende en gran medida de la intensidad de las fuerzas atómicas (en el caso de las sustancias minerales), de las fuerzas intermoleculares (sustancias orgánicas y bioquímicas) o de las fuerzas intramoleculares (sustancias bioquímicas).
La cristalización es también una técnica química de separación sólido-líquido, en la que se produce la transferencia de masa de un soluto desde la solución líquida a una fase cristalina sólida pura.
En ingeniería química, la cristalización se produce en un cristalizador. Por tanto, la cristalización está relacionada con la precipitación, aunque el resultado no es amorfo o desordenado, sino un cristal.
Fundamento teórico detrás de la cristalización
En opinión de muchas personas, los cristales son hermosos especímenes de la naturaleza (Figura 1). Muchos cristales tienen líneas y aristas largas, forman patrones geométricos y tienen superficies transparentes que reflejan la luz y hacen que brillen. El aspecto macroscópico de un cristal es un resultado directo de su estructura microscópica, en la que una unidad regular y repetitiva forma una red cristalina tridimensional.
La uniformidad y la repetición estructural diferencian un cristal de un sólido amorfo. Por esta razón, existe una diferencia entre la precipitación (la rápida formación de un sólido), y la cristalización (el lento crecimiento de un sólido con estructura microscópica regular). Los sólidos precipitados suelen tener menor pureza que los cristales, por lo que la cristalización interesa a los químicos orgánicos (¡y a los geólogos!).



La cristalización se utiliza en el laboratorio de química como técnica de purificación de sólidos. Un sólido impuro se disuelve completamente en una cantidad mínima de disolvente caliente y en ebullición, y la solución caliente se deja enfriar lentamente. Lo ideal es que se formen cristales de gran pureza, mientras que las impurezas permanecen en la solución saturada que rodea al sólido (llamada «licor madre»).
A continuación, el sólido cristalizado se filtra para separarlo de las impurezas. En la figura 2 se muestra un diagrama del procedimiento de cristalización.
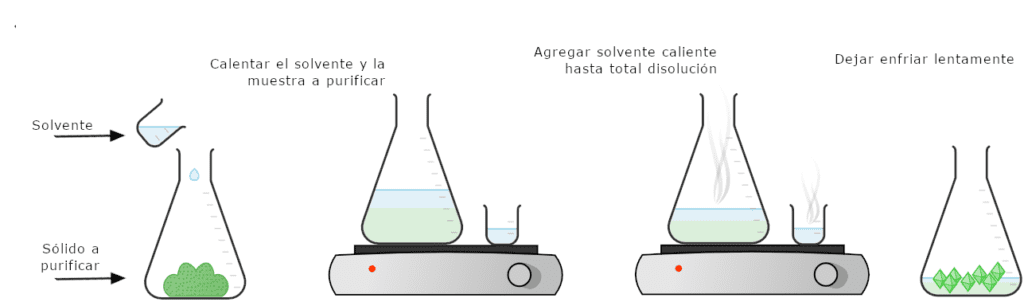
Como un sólido impuro puede haberse formado originalmente mediante una cristalización parcial, algunos llaman a este procedimiento «recristalización», ya que se permite que el sólido cristalice por segunda vez en condiciones más cuidadosas. En este capítulo, la técnica se denominará cristalización, lo que no implica ningún proceso previo.
Usos de la cristalización
El principal uso de la cristalización en el laboratorio de química orgánica es la purificación de sólidos impuros: ya sean reactivos que se han degradado con el tiempo o productos sólidos impuros de una reacción química.
Purificación de reactivos
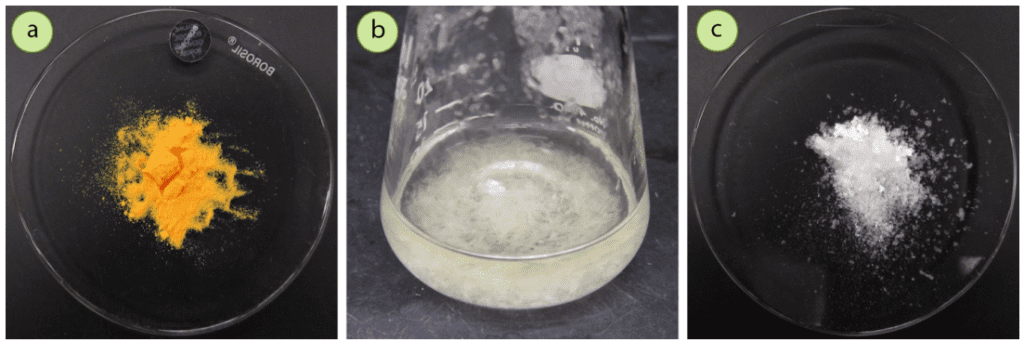
La N-bromosuccinimida (NBS) es un reactivo que se utiliza, entre otras cosas, para la bromación de radicales benzílicos y alílicos. Se suele encontrar en su bote de reactivos como un sólido amarillo o naranja (Figura 3a), ya que con el tiempo el sólido se degrada y genera Br2, la fuente del color.
Antes de usarlo, el NBS debe cristalizarse en agua caliente, y los cristales resultantes son de color blanco puro (Figura 3c). Si se utilizara el NBS sin una cristalización previa, el rendimiento se vería indudablemente afectado, ya que se desconocería la cantidad de reactivo activo y podrían formarse productos secundarios debido a la presencia de un exceso de bromo.
Purificación de mezclas de productos
Si el producto bruto de una reacción química es un sólido, puede cristalizarse para eliminar las impurezas. Por ejemplo, el ácido benzoico puede bromarse para producir ácido m-bromobenzoico (Figura 4). Es muy probable que el producto sólido crudo contenga ácido benzoico no reactivo, y esta impureza podría eliminarse mediante la cristalización.
Para demostrarlo, una mezcla que contenía aproximadamente 85 mol% de ácido p-bromobenzoico (un sólido) contaminado con 15mol% de ácido benzoico (otro sólido) tenía un tinte amarillo (Figura 5a), y tras la cristalización el sólido resultante era blanco puro (Figura 5c). La cristalización parecía purificar la mezcla basándose en la ligera mejora del color.

Más fiable que la apariencia, se demostró que la cristalización había purificado efectivamente la mezcla mediante el análisis del punto de fusión y la RMN 1H de los sólidos crudos y cristalizados. El punto de fusión del sólido crudo era de 221-250°C, mientras que el punto de fusión del sólido purificado era de 248-259°C (el punto de fusión del ácido p-bromobenzoico según la literatura es de 252-254°C).
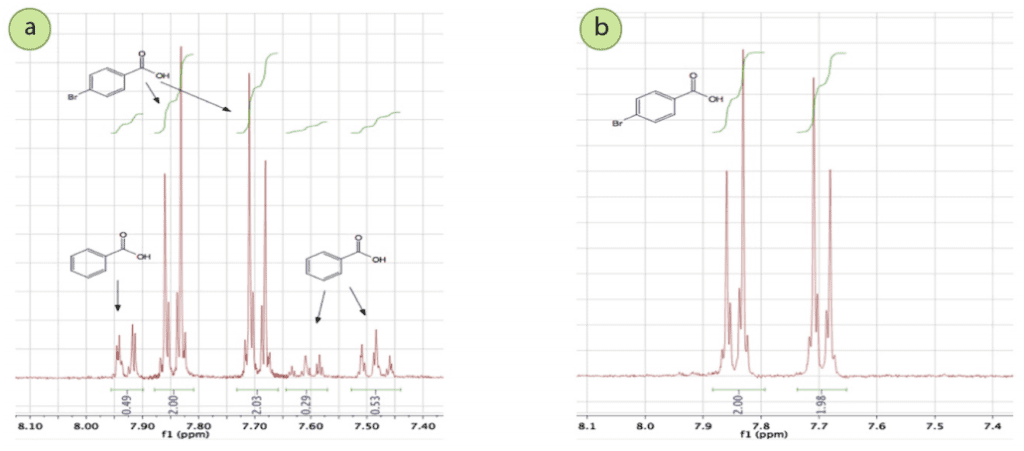
El punto de fusión del sólido cristalizado se agudizó significativamente, indicando una mayor pureza. Además, en el espectro de RMN 1H del sólido crudo (Figura 6a), hay señales tanto del ácido p-bromobenzoico como del ácido benzoico, y las integraciones se correlacionan razonablemente bien con la composición original de la mezcla.
En el espectro de RMN 1H del sólido cristalizado (Figura 6b), las señales del ácido benzoico han desaparecido por completo, lo que demuestra que la cristalización purificó con éxito el ácido p-bromobenzoico. Una purificación análoga podría realizarse si una reacción de bromación produjera una mezcla de ácido m-bromobenzoico y ácido benzoico.
Para más información Purification of Product Mixtures
Como citar este artículo:
APA: (2021-04-21). Introducción a la cristalización. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-a-la-cristalizacion/
ACS: . Introducción a la cristalización. https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-a-la-cristalizacion/. Fecha de consulta 2026-02-27.
IEEE: , "Introducción a la cristalización," https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-a-la-cristalizacion/, fecha de consulta 2026-02-27.
Vancouver: . Introducción a la cristalización. [Internet]. 2021-04-21 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-a-la-cristalizacion/.
MLA: . "Introducción a la cristalización." https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-a-la-cristalizacion/. 2021-04-21. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net
