Tiempo de lectura estimado: 8 minutos
El método de Thiele es una técnica de laboratorio que permite estimar el punto de fusión de una sustancia pura de manera sencilla con una buena precisión.
¿Que es el punto de fusión?
Los puntos de fusión y ebullición son las temperaturas a las cuales se genera un cambio en el estado de agregación. En el caso del punto de fusión, la sustancia pasa de estado sólido a estado líquido cuando se le agrega energía.
Si se sigue agregando energía al sistema, se producirá un aumento paulatino de la temperatura hasta alcanzar el punto de ebullición, donde la sustancia pasa de estado líquido a estado vapor. El método de Thiele es una técnica sencilla para la determinación del punto de fusión de manera rápida en cualquier laboratorio con equipos sencillos.
Dichos puntos de fusión y ebullición son característicos de una sustancia pura y ayudan en su identificación, así como conocer su pureza y fueron los primeros métodos que se emplearon para distinguir y clasificar los compuestos puros que se descubrían a medida que avanzaba el estudio en los campos de la química orgánica e inorgánica.
En la actualidad se disponen de métodos de análisis más avanzados y complejos, que permiten una rápida e inequívoca caracterización de una sustancia, sin embargo, la sencillez y efectividad de la determinación de los puntos de fusión y ebullición al momento de identificar una sustancia sigue siendo de utilidad en diversos campos de la química y la industria.
Importancia del punto de fusión
Los puntos de fusión y ebullición indican la temperatura en la cual se produce un cambio en el estado de agregación de una sustancia pura. Desde el punto de vista termodinámico, el estado de agregación de un elemento o compuesto depende de la cantidad de energía que posee dicho elemento o compuesto.
Cuando la sustancia tiene una cantidad baja de energía, su estado de agregación es sólido, a medida que la sustancia recibe energía de sus alrededores, los átomos o moléculas de esta comienzan a almacenarla.
Si este proceso prosigue, llega un momento en el cual la interacción entre las partículas cambia, e inicia el proceso de transición de fase solido a fase liquida. Esta transición consume energía, así que la temperatura de la sustancia en cuestión no va a aumentar hasta que la última partícula (átomo o molécula) haya cambiado de fase. Por esta razón, se dice que este proceso es isotérmico.
Cuando la ultima molécula o el ultimo átomo cambia de fase, si se sigue suministrando energía, se observará un aumento en la temperatura. Este aumento seguirá hasta que se inicia el cambio de fase liquida a fase vapor o gas, el cual también es un proceso isotérmico y que finalizara cuando toda la sustancia haya cambiado de fase.
¿Como determinar un punto de fusión?
Para una sustancia pura el rango del punto de fusión no debe pasar de 0,5 a 1,0 ºC o funde con descomposición en no más de un grado centígrado. Si el rango de fusión es mayor, se debe a varios factores como la pureza (es necesario recristalizarla en un solvente apropiado y determinar de nuevo su punto de fusión).
También si la muestra se calienta rápidamente y la velocidad de dilatación del mercurio (en el termómetro) es menor que la velocidad de ascenso de la temperatura en la muestra. Por último, si se tiene mucha sustancia como muestra en el sistema de determinación del punto de fusión.
Algunas sustancias orgánicas como, aminoácidos, sales de ácidos, aminas y carbohidratos funden descomponiéndose en rangos grandes de temperatura siendo puros. Cuando esto sucede es muy difícil determinar el punto de fusión. Por ello para estas sustancias se recomienda efectuar el calentamiento previo del sistema a unos 10ºC por debajo de su valor de fusión e introducir la sustancia y calentar cuidadosamente.
Por otro lado, para aquellas sustancias que tienen punto de ebullición bajo cero y, se puede utilizar un baño refrigerante (hielo seco, hielo con sal, etc). Una vez solidificada la sustancia, se extrae y se observa el ascenso del termómetro hasta determinar el valor de temperatura cuando la sustancia recupera nuevamente su estado líquido. A veces, cuando la sustancia no está lo suficientemente pura, la congelación puede presentar dificultades.
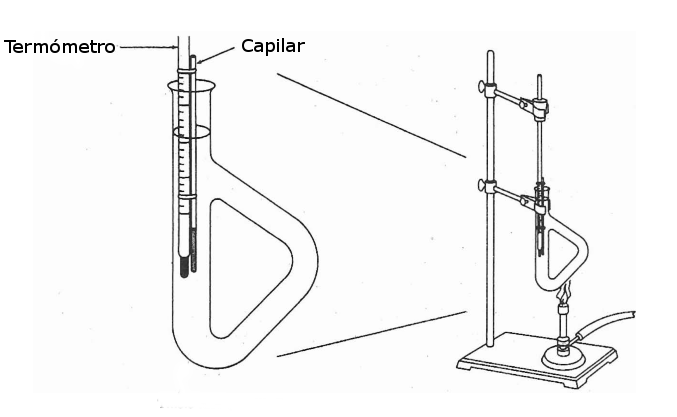
Método de Thiele
El método de Thiele es basado en la observación del fenómeno de fusión de una pequeña cantidad de la sustancia que se está analizando, por esta razón, es necesario controlar la cantidad de solido que se coloca en el capilar para que sea lo suficientemente significativa para ser observada a través del aceite, pero bastante pequeña para que el cambio de fase de solido a liquido sea casi instantáneo y se pueda determinar la temperatura de fusión con gran precisión.
El método fue desarrollado por Johannes Thiele, químico alemán pionero en el análisis orgánico, y emplea un aparato de vidrio de forma triangular, llamado tubo de Thiele, que permite que la temperatura del aceite que se emplea para la técnica sea igual en todo su volumen, y caliente la muestra de manera uniforme.
Materiales
- Tubo de Thiele
- Capilares de vidrio
- 2 pinzas con nuez
- Soporte universal
- Mechero Bunsen
- Mortero
- Termómetro
- Aceite mineral
- Alambre de cobre
Reactivos
- 3 muestras de compuestos orgánicos sólidos*
* Las muestras de sólidos deben ser lo menos tóxicos posibles.
Procedimiento
Tiempo necesario: 1 hora y 30 minutos
Determinación del punto de fusión
- Preparación de capilar
Tome un capilar de vidrio (suministrado en el laboratorio) y séllelo por un extremo utilizando el mechero Bunsen. Para sellarlo, se toma de un extremo y el otro se acerca a la llama del mechero Bunsen en la zona más caliente, debe girarse sobre si mismo de manera constante para crear un sello uniforme, retirar de la llama y observar si el capilar se ha sellado. Sellar 8 tubos capilares más. Dejar enfriar.
Anuncio - Preparación e introducción de la muestra
Si la muestra a examinar es muy gruesa, esta debe ser pulverizada empleando un mortero y mano.
Tomar una pequeña porción de la muestra colocando la boca abierta del capilar en el polvo obtenido de la muestra de manera vertical. Enderezar el capilar y agitar suavemente para llevar la muestra al fondo.
Si la cantidad no es visible, agregar un poco más. La cantidad debe ser suficiente para observar la fusión a simple vista. Llenar tres tubos capilares por cada solido a ensayar.
- Montaje método de Thiele
El capilar con la muestra debe ser fijado al termómetro con la ayuda de un alambre de cobre (PRECAUCIÓN, no ejercer mucha fuerza ya que puede romper el capilar o el termómetro)
Anuncio Realizar el montaje indicado. Llenar el tubo de Thiele hasta ¾ partes con aceite mineral e introducir el montaje termómetro-capilar de tal forma que el capilar quede cubierto ¾ partes por aceite mineral. Todas las piezas del montaje deben estar secas previamente para evitar salpicaduras del aceite al iniciar el calentamiento.

Iniciar el calentamiento del sistema, se debe controlar el ascenso de temperatura observando la muestra, cuidando que no se sobrecaliente el sistema. Observar el solido dentro del capilar mientras se monitorea la temperatura (es ideal realizar el ensayo entre dos personas, uno observa la sustancia mientras el otro observa la temperatura).
Cuando haya fundido la sustancia, se lee la temperatura registrada en el termómetro.
AnuncioDejar enfriar el sistema y extraer el conjunto termómetro – capilar. Atar un nuevo capilar al termómetro y repetir el procedimiento de calentamiento. Realizar el procedimiento hasta determinar los puntos de fusión de cada muestra solida por triplicado.
Anotar todos los valores de temperatura obtenidos y cualquier observación adicional.
Después del experimento
Llenar la siguiente tabla con los datos obtenidos
Para calcular el porcentaje de error en la medición de la temperatura de fusión, primero se debe calcular la temperatura de fusión promedio con los datos obtenidos en el laboratorio, sumando los tres valores y dividiendo el resultado en tres.
Posteriormente se debe restar la temperatura de fusión promedio del valor teórico o reportado para la sustancia en literatura. Si la resta da un valor negativo se debe tomar el valor absoluto de este.
El porcentaje de error se obtendrá al dividir la diferencia obtenida anteriormente en el valor de temperatura de fusión teórico y multiplicar dicho resultado por 100.
Compare con los valores encontrados en la literatura ¿Qué factores pueden ser considerados para explicar la diferencia entre los puntos de fusión obtenidos en la practica y los reportados en la literatura?
En los sólidos ensayados, ¿la fusión del solido se observó a una temperatura constante o en un rango de temperaturas? ¿Qué significa si se observa un rango de temperaturas?
¿Qué se puede concluir sobre la pureza de las muestras analizadas a la luz de las temperaturas de fusión obtenidas?
Recomendaciones de seguridad
Todos los elementos del montaje deben estar secos antes de aplicar el aceite mineral, de lo contrario, al calentarse pueden presentarse proyecciones del aceite mineral caliente.
Se debe controlar el aumento de la temperatura del sistema para que sea constante pero no muy rápido. Manejar con cuidado los elementos calientes (el vidrio caliente tiene el mismo aspecto que el vidrio frío)
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales.
Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Mayor información
Como citar este artículo:
APA: (2019-01-09). Determinación del punto de fusión – Método de Thiele. Recuperado de https://quimicafacil.net/manual-de-laboratorio/metodo-de-thiele/
ACS: . Determinación del punto de fusión – Método de Thiele. https://quimicafacil.net/manual-de-laboratorio/metodo-de-thiele/. Fecha de consulta 2026-02-27.
IEEE: , "Determinación del punto de fusión – Método de Thiele," https://quimicafacil.net/manual-de-laboratorio/metodo-de-thiele/, fecha de consulta 2026-02-27.
Vancouver: . Determinación del punto de fusión – Método de Thiele. [Internet]. 2019-01-09 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/metodo-de-thiele/.
MLA: . "Determinación del punto de fusión – Método de Thiele." https://quimicafacil.net/manual-de-laboratorio/metodo-de-thiele/. 2019-01-09. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net