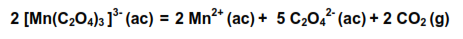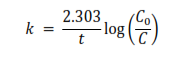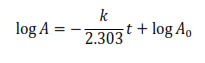Tiempo de lectura estimado: 6 minutos
La espectrofotometría es una técnica estándar y económica para medir la absorción de la luz o la cantidad de sustancias químicas en una solución. Utiliza un haz de luz que atraviesa la muestra y cada compuesto de la solución absorbe o transmite la luz en una determinada longitud de onda.
La espectrometría se mide con un espectrofotómetro, un instrumento compuesto por dos aparatos: un espectrómetro y un fotómetro. El espectrómetro produce la luz de la longitud de onda y el fotómetro mide la intensidad de la luz midiendo la cantidad de luz que atraviesa la muestra.
Además de estos dos componentes, los espectrofotómetros constan de una fuente de luz, un monocromador, una cámara de muestras que contiene una cubeta, un detector (como un tubo fotomultiplicador o un fotodiodo) para detectar la luz transmitida, una pantalla digital y un paquete de software de análisis de datos.
Descomposición del ion tris(oxalato) manganato (III)
En esta práctica de laboratorio se estudia la descomposición del ion tris(oxalato) manganato (III) por un método espectrofotométrico
El mecanismo de este proceso responde a varios pasos elementales, lo cual puede colegirse de la simple inspección visual de la ecuación global.
La cinética de la reacción se describe por una ecuación de primer orden:
Donde
- K es la constante de velocidad específica.
- C0 es la concentración del ion complejo al inicio de la reacción
- C es la concentración del ion complejo a un tiempo t dado
La disolución del ion tris(oxalato) manganato (III), es de color pardo, en tanto que los productos son incoloros. Por consiguiente, cuando la reacción avanza la mezcla reaccionante se decolora. Por esta razón, para estudiar el desarrollo de este proceso se puede utilizar un método espectrofotométrico.
La ley fundamental en que se basan las mediciones fotométricas relaciona la concentración de la disolución absorbente con la absorbancia y es la ley de Lambert-Beer-Bouguer. Esta ley se expresa como:
Donde
- A es la absorbancia de la disolución absorbente a una longitud de onda λ
- I0 es la intensidad del flujo luminoso incidente
- I es la intensidad del flujo luminoso después de atravesar la capa de la disolución investigada
- ξ es un factor de proporcionalidad denominado absortividad molar
- c es la concentración de la disolución
- l es la longitud de la disolución atravesada por el haz luminoso
El complejo en estudio presenta una banda en la región visible del espectro electromagnético cuyo máximo de absorción se encuentra a una longitud de onda de 458 nm, mientras que los productos de la reacción, al ser incoloros, no absorben en la región visible, por lo que a esta longitud de onda la absorbancia es directamente proporcional a la concentración del ion complejo reaccionante según la relación anterior.
De esta forma, para investigar la cinética de este proceso se puede utilizar el método de la propiedad física, correspondiendo a la propiedad física los valores de la absorbancia de la mezcla reaccionante a 458 nm. La ecuación resultante es
Donde
- A0 es la absorbancia al inicio de la reacción
- A∞ es la absorbancia al final de la reacción
- A es la absorbancia a un tiempo t
Para la reacción en estudio A∞ = 0, pues corresponde al valor de la absorbancia cuando se ha consumido todo el ion complejo que es la sustancia que absorbe a la longitud de onda en que se trabaja. Por lo tanto
Si se quiere utilizar un método gráfico de trabajo, la expresión anterior se puede escribir de la siguiente forma
Formación del ion tris (oxalato) manganato (III)
El ion complejo se forma en la reacción entre el sulfato de manganeso y el permanganato de potasio en presencia de ácido oxálico:
Materiales
- 3 balones aforados de 50 mL
- 3 vidrios de reloj
- 3 pipetas graduadas de 10 mL
- Pipeta aforada de 1 mL
- Beaker o vaso de precipitados de 50 mL
- Espectrofotómetro
- Balanza analítica
- Cronometro
- Propipeta o pipeteador
- Cubeta para espectrofotómetro plástica o de cuarzo
Reactivos
Disoluciones
- KMnO4 0.01 M
- MnSO4 0.1 M
- H2C2O4 0.1 M
Procedimiento
Encender el espectrofotómetro y ajustar la longitud de onda a 458 nm.
Medir 1 mL de la disolución 0.1 M de sulfato de magnesio y 7 mL de disolución 0.1 M de ácido oxálico y colocarlas en un beaker pequeño.
Añadir 2 mL de disolución 0.1 M de permanganato de potasio a la disolución en el beaker.
Colocar rápidamente la disolución reaccionante en una cubeta de 100 mm y determinar inmediatamente el valor de absorbancia (A0). En ese momento poner en marcha el cronómetro.
Realizar las medidas fotométricas cada 2 minutos hasta que la absorbancia de la mezcla reaccionante alcance un valor aproximado de 0.1.
Repetir por triplicado.
Después del laboratorio
Determine la media de los valores de k obtenidos en las experiencias y la incertidumbre asociada.
Para más información A study of the kinetics of the permanganate-oxalate reaction
Como citar este artículo:
APA: (2022-04-27). Estudio de la cinética por un método espectrofotométrico. Recuperado de https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/estudio-de-la-cinetica-por-un-metodo-espectrofotometrico/
ACS: . Estudio de la cinética por un método espectrofotométrico. https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/estudio-de-la-cinetica-por-un-metodo-espectrofotometrico/. Fecha de consulta 2026-02-14.
IEEE: , "Estudio de la cinética por un método espectrofotométrico," https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/estudio-de-la-cinetica-por-un-metodo-espectrofotometrico/, fecha de consulta 2026-02-14.
Vancouver: . Estudio de la cinética por un método espectrofotométrico. [Internet]. 2022-04-27 [citado 2026-02-14]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/estudio-de-la-cinetica-por-un-metodo-espectrofotometrico/.
MLA: . "Estudio de la cinética por un método espectrofotométrico." https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/estudio-de-la-cinetica-por-un-metodo-espectrofotometrico/. 2022-04-27. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net