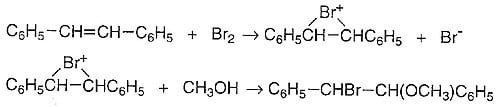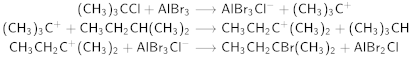Tiempo de lectura estimado: 10 minutos
Paul Doughty Bartlett (14 de agosto de 1907, Ann Arbor, Michigan – 11 de octubre de 1997) fue un químico orgánico estadounidense, fundador de la escuela de química orgánica física, miembro de la Academia Nacional de Ciencias de Estados Unidos (desde 1947).
Vida temprana y educación de Bartlett
Paul D. Bartlett nació en Ann Arbor, Michigan, el 14 de agosto de 1907 y creció en Indianápolis, Indiana, donde asistió a escuelas públicas. Se matriculó en Amherst College y se graduó con honores en 1928.
Luego se matriculó en un programa de posgrado y continuó trabajando en el campo de la química con James Bryant Conant en Harvard. En 1932, él y Conant publicaron un estudio sobre las velocidades y equilibrios de la formación de semicarbazona en solución acuosa, un estudio que aclaró la diferencia entre las velocidades y los equilibrios.
Carrera de Bartlett
Bartlett fue claramente identificado como sucesor de Conant en química orgánica teórica. Sin embargo, en ese momento, el departamento de química de Harvard se aferraba a la doctrina de que no contrataría a ninguno de sus estudiantes o becarios hasta que se fuera a otro lugar y demostrara la originalidad de sus publicaciones.
La idea era no permitir que el profesor dominante (que sin duda era Conant) llenara la cátedra con sus estudiantes hasta que demostraran independencia en su trabajo científico. Bartlett trabajó durante un año como becario en el Instituto Rockefeller en Nueva York, y luego enseñó durante dos años en la Universidad de Minnesota.
De esta manera, Bartlett cumplió con el requisito del departamento de realizar trabajo independiente; pasó todas las pruebas y pudo ser incluido de manera segura en la facultad de química de Harvard. Rápidamente ascendió en su carrera como profesor, pasando de instructor a profesor asociado y luego a profesor asistente de química de Erving. Al mismo tiempo, Bartlett enseñó su famoso curso, enseñó a sus colegas y realizó sus descubrimientos fundamentales.
Primeros descubrimientos de Bartlett
Entre sus primeros descubrimientos se encuentra su trabajo con Stanley Tarbell. Investigaron la cinética y formación de productos en la bromación de estilbeno en metanol como disolvente y establecieron que era un proceso de dos etapas en el que se formaba un producto intermedio catiónico a partir de estilbeno y bromo, seguido por la reacción de este producto intermedio con metanol o iones bromuro.
Varios años después, George Kimball e Irving Roberts propusieron la hipótesis de que el catión de Bartlett y Tarbell era un ión de bromonio cíclico.
Segunda carrera y jubilación de Bartlett
En 1972, Bartlett decidió dejar Harvard y aceptar el puesto de profesor en Welch en la Universidad Cristiana de Texas en Fort Worth. Allí continuó atrayendo a científicos para trabajar con él y comenzó una segunda carrera. En TCU, colaboró frecuentemente con U. H. Watson, un experto en cristalografía de rayos X, para determinar la estructura de los productos de reordenamiento de los carbaniones, expandiendo efectivamente el conjunto de herramientas para resolver problemas de química física orgánica. Cuando se jubiló (de TCU en 1985), regresó a Harvard.
Aportes a la química
Investigación sobre halógenos en grupos puente
Bartlett publicó alrededor de 300 trabajos sobre química, algunos de los cuales abrieron nuevos horizontes. En 1939, él y Lawrence Knox publicaron un estudio sobre halógenos en grupos puente. En particular, sintetizaron 1-bromonorbornano y demostraron que el halógeno es extremadamente inerte ante la acción de una solución caliente de hidróxido de sodio o de nitrato de plata caliente.
Bartlett postuló que los carbaniones con solo seis electrones alrededor del átomo de carbono central no son estables si no son planos, y, por supuesto, que un ión bicíclico, si existiera, estaría limitado por una geometría completamente diferente y no plana.
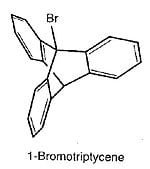
Varios años después, él y Sol Cohen confirmaron el descubrimiento de Knox y lo ampliaron, sintetizando tripticeno y (junto con E. S. Lewis y Josephine Ryan, y más tarde con Fred Green) los correspondientes bromuro e yoduro en grupos puente.
Estos dos halogenuros resultaron ser aún más inertes; la reacción con nitrato de plata ocurre al menos 1015 veces más rápido con ter-butilbromuro que con 1-yodotripticeno. El catión trifenilmetilo es lo suficientemente estable, mientras que el catión correspondiente del tripticeno no puede formarse.
Carbocationes reactivos
En 1944, Bartlett hizo otro descubrimiento muy original junto con dos de sus estudiantes de posgrado, F. E. Condon y Abraham Schneider: descubrieron la reacción de intercambio de hidrógeno y halógeno.
En presencia de cantidades catalíticas de ácido de Lewis (bromuro de aluminio), el cloruro de ter-butilo reacciona con el isopentano para producir bromuro de ter-amilo y isobutano; la reacción toma solo alrededor de 0,001 segundos.
Presumiblemente, el alquilhalogenuro terciario reacciona con el halogenuro de aluminio para producir el catión ter-butilo, que a su vez arranca un átomo de hidrógeno terciario del alcano. El supuesto carácter inerte de los alcanos es ilusorio; reaccionan bastante fácilmente con los carbocationes. Bartlett presentó la secuencia de reacciones de la siguiente manera:
Antes del trabajo de Bartlett, Condon y Schneider, no se había desarrollado el campo de las reacciones de los hidrocarburos combustibles; posteriormente se convirtió en un campo científico aparte. Este gran descubrimiento, realizado en el laboratorio de Bartlett en 1944, fue un requisito previo importante cuatro décadas más tarde para el trabajo de George Ohl sobre las reacciones de las parafinas en soluciones superácidas, por el que fue galardonado con el Premio Nobel de Química en 1994.
Iones no clásicos
Bartlett y sus estudiantes realizaron una serie de descubrimientos en la química de los carboniones. Estos descubrimientos se resumieron posteriormente en una monografía titulada Iones no clásicos (Benjamin, 1965), que Bartlett editó. Con su modestia habitual, presentó muchos artículos de Winstein, Roberts y otros, y sólo uno suyo. Pero ha interpretado todos los artículos que ha seleccionado y los ha combinado con sus comentarios en un conjunto útil.
Investigación sobre la química de radicales libres
La tercera área de investigación importante en el laboratorio de Bartlett fue la química de los radicales libres. Él y K. G. Swayne llevaron a cabo la primera investigación utilizando el método del rotor de sector para encontrar las constantes de velocidad para la polimerización de radicales libres en solución. Posteriormente, él y F. A. Tate llevaron a cabo la reacción de polimerización de acetato de alilo que sigue un mecanismo de radicales libres, utilizando un sustrato selectivamente deuterado CH2 = CH-CD2-O-COCH3 y la acción de la luz.
Este compuesto deuterado se polimeriza dos o tres veces más rápido y el polímero resultante es más de dos veces más largo que la polimerización de acetato de alilo normal. La polimerización de acetato de alilo, al igual que otras reacciones de polimerización de radicales libres, es una reacción en cadena, y Bartlett explicó el efecto isotópico muy inusual que él y Tate descubrieron (donde el sustrato deuterado reacciona más rápido, no más lento, que su contraparte de hidrógeno) como resultado del ataque del átomo de deuterio en la etapa de ruptura de cadena en la reacción de polimerización.
Bartlett y Swayne utilizaron el método del rotor de sector para encontrar las constantes de velocidad para la polimerización de radicales libres en solución. Junto con Tate llevaron a cabo la reacción de polimerización de acetato de alilo que sigue un mecanismo de radicales libres, utilizando un sustrato selectivamente deuterado CH2 = CH-CD2-O-COCH3 y la acción de la luz.
Bartlett explicó el efecto isotópico muy inusual que él y Tate descubrieron (donde el sustrato deuterado reacciona más rápido, no más lento, que su contraparte de hidrógeno) como resultado del ataque del átomo de deuterio en la etapa de ruptura de cadena en la reacción de polimerización.
Oxígeno singlete
La oxidación por aire también es un ejemplo de reacciones de radicales libres. El oxígeno normal existe en un estado triplete 3O2 (es decir, como un birradical). A diferencia de lo normal, donde el estado fundamental de la molécula (es decir, el estado de menor energía) tiene solo electrones apareados, el estado fundamental del oxígeno es un triplete con dos electrones no apareados; el oxígeno singlete (1O2), en el cual no hay nada más que electrones apareados, es una forma altamente energética.
El oxígeno triplete reacciona rápidamente con radicales (es decir, con otras moléculas que tienen electrones no apareados), pero afortunadamente reacciona relativamente lentamente con un mayor número de compuestos con electrones apareados. Bartlett obtuvo oxígeno singlete mediante la fotactivación y descomposición de ozónidos de fosfito. Demostró que el ozónido de trimetilfosfito es estable a muy bajas temperaturas, pero se descompone fácilmente para formar oxígeno singlete al calentar a temperatura ambiente.
El estado fundamental del oxígeno es un triple con dos electrones no apareados.
El oxígeno singlete (1O2), en el cual no hay nada más que electrones apareados, es una forma altamente energética.
Bartlett obtuvo oxígeno singlete mediante la fotactivación y descomposición de ozónidos de fosfito.
El ozónido de trimetilfosfito es estable a muy bajas temperaturas, pero se descompone fácilmente para formar oxígeno singlete al calentar a temperatura ambiente.
α-lactonas
Varios investigadores han postulado que las α-lactonas participan en reacciones químicas como intermediarios de vida corta, pero nunca se han observado en la práctica. Bartlett y Robert Wieland sintetizaron e identificaron la ditrebutil-α-lactona por oxidación del ditrebutilceteno con ozono. La α-lactona era estable en solución a -78° y podía identificarse por sus espectros. Este trabajo, que demostró la realidad de las α-lactonas, las situó en la categoría de intermedios de alta energía.
Actividad docente
Bartlett introdujo un curso de química orgánica en Harvard, basado principalmente en mecanismos de reacción para estudiantes de primer año de posgrado y estudiantes avanzados. Revisaba su curso anualmente a medida que se desarrollaba esta área.
Graduados destacados
Muchos jóvenes químicos estadounidenses fueron atraídos a Harvard para trabajar con Bartlett, y sus estudiantes de posgrado ocupan puestos destacados como profesores en universidades y en importantes posiciones en la industria en todo el país. Entre los graduados se encontraban Norman Allinger (Universidad de Georgia), Ned Arnett (Duque), Myron Bender (Universidad del Noroeste), Sol Cohen (Brandeis), Fred Green II (Instituto Tecnológico de Massachusetts), George Hammond (Instituto de Tecnología de California, luego en la industria), Daniel Koshland Jr. (Universidad de California, Berkeley), John D. Roberts (Instituto de Tecnología de California), K. Gardner Swain (Instituto Tecnológico de Massachusetts), D. Stanley Tarbell (Vanderbilt), Nick Turro (Columbia) y Sol Winstein (Universidad de California, Los Ángeles).
Muchos de los destacados colaboradores de Bartlett impartieron cursos de química orgánica avanzada basados en su curso en Harvard y difundieron sus ideas. Muchos de sus discípulos científicos continúan hoy en día con sus tradiciones en química orgánica física.
En total, más de 270 estudiantes, estudiantes de posgrado y colaboradores científicos trabajaron en el laboratorio de Bartlett.
Muchos de los destacados colaboradores de Bartlett impartieron cursos de química orgánica avanzada basados en su curso en Harvard y difundieron sus ideas.
Para más información Paul D. Bartlett
Como citar este artículo:
APA: (2023-08-14). Paul D. Bartlett. Recuperado de https://quimicafacil.net/infografias/biografias/paul-d-bartlett/
ACS: . Paul D. Bartlett. https://quimicafacil.net/infografias/biografias/paul-d-bartlett/. Fecha de consulta 2026-03-04.
IEEE: , "Paul D. Bartlett," https://quimicafacil.net/infografias/biografias/paul-d-bartlett/, fecha de consulta 2026-03-04.
Vancouver: . Paul D. Bartlett. [Internet]. 2023-08-14 [citado 2026-03-04]. Disponible en: https://quimicafacil.net/infografias/biografias/paul-d-bartlett/.
MLA: . "Paul D. Bartlett." https://quimicafacil.net/infografias/biografias/paul-d-bartlett/. 2023-08-14. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net