Estimated reading time: 5 minutos
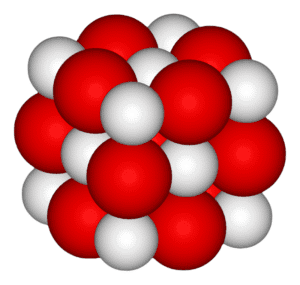
El óxido de calcio (CaO), comúnmente conocido como cal viva o cal quemada, es un compuesto químico ampliamente utilizado. Es un sólido blanco, cáustico y alcalino a temperatura ambiente.
El término «cal» se refiere al compuesto que contiene calcio, incluyendo carbonato, hidróxido y óxido. La cal viva es relativamente económica de producir y, junto con sus derivados químicos, es una de las materias primas más importantes en diversas industrias.
Historia y Etimología
El Efecto «Limelight» (Candilejas)
La cal viva es la protagonista de la histórica tecnología de iluminación conocida como «limelight» o «luz de calcio», de donde proviene la expresión en inglés «estar en el centro de atención» (being in the limelight). Este efecto fue descubierto en la década de 1820 por el inventor Goldsworthy Gurney.
El proceso no implica la combustión de la cal, sino que se calienta un bloque de óxido de calcio con una llama de oxihidrógeno a temperaturas cercanas a los 2,000°C. A esta temperatura, la cal emite un resplandor blanco e intenso, un fenómeno conocido como termoluminiscencia. Esta luz era significativamente más brillante que la de las velas utilizadas hasta entonces en los teatros.
El ingeniero escocés Thomas Drummond adaptó esta tecnología para crear la lámpara de Drummond, un foco que utilizaba un reflector parabólico para dirigir la intensa luz. Estas lámparas reemplazaron rápidamente a las velas en los teatros y salas de música de todo el mundo.
Peligros y Declive del «Limelight»
A pesar de su eficacia, las lámparas de calcio eran extremadamente peligrosas. Requerían el almacenamiento de gases altamente inflamables como hidrógeno y oxígeno junto a una fuente de ignición, lo que representaba un grave riesgo de incendio, especialmente cerca de materiales combustibles como las cortinas de los teatros.
Durante el siglo XIX, numerosos incendios teatrales devastadores, con cientos de víctimas mortales, fueron atribuidos a la iluminación de escenario. Estos desastres impulsaron cambios en las leyes de seguridad para lugares públicos, como la exigencia de salidas de emergencia adecuadas y telones de seguridad ignífugos. Con la llegada de la iluminación eléctrica a principios del siglo XX, el uso del «limelight» fue abandonado.
Producción
El óxido de calcio se produce industrialmente mediante la descomposición térmica de materiales ricos en carbonato de calcio (CaCO3), como la piedra caliza o las conchas marinas, en un horno de cal. Este proceso, conocido como calcinación, se lleva a cabo calentando el material a temperaturas superiores a los 900°C para liberar el dióxido de carbono (CO2).
La reacción química es la siguiente:
Imagen sugerida:
- Fotografía de un horno de cal moderno o una cantera de piedra caliza. «
Propiedades Químicas
La cal viva es químicamente activa. Su reacción más notable es con el agua, un proceso conocido como apagado o hidratación de la cal (slaking en inglés). Al añadir agua a la cal viva, se produce una reacción muy exotérmica que genera hidróxido de calcio (Ca(OH)2), también conocido como cal apagada o cal hidratada. El calor liberado es suficiente para hacer hervir el agua.
La reacción es:
La cal viva es extremadamente cáustica y puede causar quemaduras en la piel, mientras que la cal apagada, aunque sigue siendo alcalina, es menos peligrosa de manipular.
Usos y Aplicaciones
Construcción
El uso principal del óxido de calcio es en la industria de la construcción. Es un componente clave del mortero, el yeso y, sobre todo, del cemento. El cemento Portland, patentado en 1824 por Joseph Aspdin, es el tipo más común en la actualidad y se fabrica a partir de CaO, sílice (SiO2) y yeso. Este cemento es el aglutinante del hormigón, el segundo material más utilizado en el mundo después del agua.
Sin embargo, la producción de cemento tiene un impacto ambiental significativo, ya que se estima que contribuye con cerca del 10% de las emisiones mundiales de dióxido de carbono.

Uso en la Descomposición de Cuerpos
En la cultura popular, es común la idea de que la cal viva se utiliza para acelerar la descomposición de cadáveres y ocultar evidencia. Históricamente, se usaba para cubrir fosas comunes durante plagas con el fin de reducir los olores y la propagación de enfermedades.
Sin embargo, su efecto es el contrario. Al entrar en contacto con un cuerpo, la cal viva absorbe el agua de los tejidos en una reacción que genera calor, provocando su deshidratación. Este proceso impide la putrefacción y, en lugar de destruir el cuerpo, lo conserva, actuando como un agente de desecación que lo protege de bacterias y animales. Por lo tanto, el uso de cal viva en realidad preservaría la evidencia en lugar de eliminarla.
Como citar este artículo:
APA: (2026-01-06). Óxido de Calcio. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/oxido-de-calcio/
ACS: . Óxido de Calcio. https://quimicafacil.net/compuesto-de-la-semana/oxido-de-calcio/. Fecha de consulta 2026-02-22.
IEEE: , "Óxido de Calcio," https://quimicafacil.net/compuesto-de-la-semana/oxido-de-calcio/, fecha de consulta 2026-02-22.
Vancouver: . Óxido de Calcio. [Internet]. 2026-01-06 [citado 2026-02-22]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/oxido-de-calcio/.
MLA: . "Óxido de Calcio." https://quimicafacil.net/compuesto-de-la-semana/oxido-de-calcio/. 2026-01-06. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net