Estimated reading time: 4 minutos
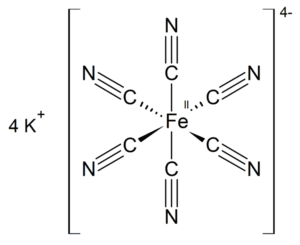
El ferrocianuro de potasio o hexacianoferrato(II) de potasio es un compuesto inorgánico con la fórmula K₄[Fe(CN)₆]·3H₂O. Es la sal de potasio del complejo de coordinación [Fe(CN)₆]⁴⁻ y forma cristales monoclínicos de color amarillo limón.
Estructura
Al igual que otros cianuros metálicos, el ferrocianuro de potasio sólido, tanto en su forma hidratada como en sales anhidras, posee una estructura polimérica compleja. El polímero consiste en centros octaédricos [Fe(CN)₆]⁴⁻ enlazados con iones K⁺ que se unen a los ligandos CN. Los enlaces K⁺—NC se rompen cuando el sólido se disuelve en agua.
Síntesis del ferrocianuro de potasio
En 1752, el químico francés Pierre Joseph Macquer (1718–1784) fue el primero en reportar la preparación del ferrocianuro de potasio, que obtuvo al reaccionar azul de Prusia (ferrocianuro de hierro(III)) con hidróxido de potasio.
Producción moderna
Actualmente, este compuesto se produce industrialmente a partir de cianuro de hidrógeno, cloruro de hierro(II) e hidróxido de calcio, cuya combinación produce Ca₂[Fe(CN)₆]·11H₂O.
Esta solución se trata luego con sales de potasio para precipitar la sal mixta de calcio y potasio, CaK₂[Fe(CN)₆], que a su vez se trata con carbonato de potasio para obtener la sal de tetrapotasio.
Producción histórica
Históricamente, el compuesto se producía a partir de material orgánico nitrogenado, limaduras de hierro y carbonato de potasio. Las fuentes comunes de nitrógeno y carbono incluían cuernos torrefactos, restos de cuero, despojos o sangre seca. También se obtenía comercialmente de los óxidos residuales de las plantas de gas (purificación de gas de ciudad de cianuro de hidrógeno).
Reacciones químicas
El tratamiento del ferrocianuro de potasio con ácido nítrico produce H₂[Fe(NO)(CN)₅]. Tras la neutralización de este intermedio con carbonato de sodio, se pueden cristalizar selectivamente cristales rojos de nitroprusiato de sodio.
Al tratar este compuesto con gas cloro, se convierte en hexacianoferrato(III) de potasio:
Esta reacción se puede utilizar para eliminar ferrocianuro de potasio de una solución.
Una reacción conocida implica el tratamiento con sales férricas para dar azul de Prusia, con la composición \(\text{Fe}^{III}_4[\text{Fe}^{II}(\text{CN})_6]_3\), un material insoluble pero intensamente coloreado que se usa en la impresión de planos.
Aplicaciones
El ferrocianuro de potasio tiene diversas aplicaciones industriales especializadas. Esta sal y la sal sódica relacionada se utilizan ampliamente como agentes antiaglomerantes tanto para la sal de carretera como para la sal de mesa.
Los hexacianoferratos(II) de potasio y sodio también se emplean en la purificación de estaño y en la separación de cobre de los minerales de molibdeno. Además, el ferrocianuro de potasio se utiliza en la producción de vino y ácido cítrico.
En la UE, los hexacianoferratos(II) (E 535–538) estaban autorizados en 2017 solo en dos categorías de alimentos como aditivos de sal. También puede emplearse en la alimentación animal.
En el laboratorio, este compuesto se usa para determinar la concentración de permanganato de potasio en titulaciones basadas en reacciones redox. Se emplea en una mezcla con ferricianuro de potasio y una solución tampón fosfatada para proporcionar un tampón para la enzima beta-galactosidasa, que se usa para descomponer X-Gal, produciendo una visualización azul brillante cuando un anticuerpo (u otra molécula), conjugado con beta-galactosidasa, se une a su objetivo. Al reaccionar con Fe(3+), da un color azul de Prusia, por lo cual se utiliza como reactivo identificador de hierro en los laboratorios.
El ferrocianuro de potasio también puede usarse como fertilizante para plantas.
Antes de 1900, antes de la invención del proceso de Castner, este compuesto era la fuente más importante de cianuros de metales alcalinos. En este proceso histórico, el cianuro de potasio se producía descomponiendo el ferrocianuro de potasio:
Toxicidad del ferrocianuro de potasio
La toxicidad en ratas es baja, con una dosis letal (LD₅₀) de 6400 mg/kg. Los riñones son el órgano más afectado por la toxicidad del ferrociánico
Para más información Potassium ferrocyanide trihydrate
Como citar este artículo:
APA: (2025-12-16). Ferrocianuro de potasio. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/ferrocianuro-de-potasio/
ACS: . Ferrocianuro de potasio. https://quimicafacil.net/compuesto-de-la-semana/ferrocianuro-de-potasio/. Fecha de consulta 2026-02-13.
IEEE: , "Ferrocianuro de potasio," https://quimicafacil.net/compuesto-de-la-semana/ferrocianuro-de-potasio/, fecha de consulta 2026-02-13.
Vancouver: . Ferrocianuro de potasio. [Internet]. 2025-12-16 [citado 2026-02-13]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/ferrocianuro-de-potasio/.
MLA: . "Ferrocianuro de potasio." https://quimicafacil.net/compuesto-de-la-semana/ferrocianuro-de-potasio/. 2025-12-16. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net