Tiempo de lectura estimado: 9 minutos
La estimación de la entropía y la energía libre de una mezcla sirve para determinar la capacidad de solvatación y el equilibrio que se presenta entre el soluto y el solvente.
Tanto la termodinámica clásica como la estadística predicen que en la formación de una disolución ideal el cambio de energía libre de mezcla, ΔGM, viene dado por la expresión.
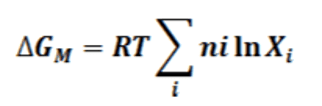
En donde ni es el número de moles del componente i y Xi su fracción molar. Para dos componentes con número de moles n1 y n2 la expresión anterior se transforma en:

Esta ecuación permite el cálculo teórico para la energía libre el cual puede confrontarse con el resultado experimental. La aplicación de esta implica un comportamiento ideal de la solución.
El cambio de energía libre se define como el máximo trabajo útil que puede realizar el sistema o en otras palabras el trabajo máximo por encima del trabajo de expansión que se obtiene en una transformación.

Si quiere apreciarse el el cambio en la energía libre de Gibbs ΔG en el laboratorio, la transformación debe realizarse en un dispositivo que permita la producción de trabajo, por ejemplo, una celda electroquímica.
Si se tiene la celda

Los electrodos de platino no participan de la reacción y la reacción total se reduce a:

El cambio de energía libre de la reacción refleja la tendencia de los dos iones a tratar de igualar sus concentraciones.
La energía libre y el potencial de la celda se relacionan por la ecuación;

O

O sea que la fuerza electromotriz de la celda es proporcional a la disminución de energía libre de Gibbs de la reacción de la celda por electrón transferido. La FEM de la celda es por tanto una propiedad intensiva del sistema; no depende del tamaño de la celda no de los coeficientes escogidos para balancear la ecuación química de la reacción. La forma diferencial de la anterior ecuación es:
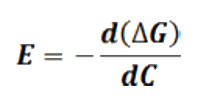
En donde C representa el producto nF que es la cantidad de electricidad pasada. Si las dos soluciones se mezclan directamente no se realiza trabajo, pero en la celda electroquímica descrita la misma mezcla ocurre como resultado de la reacción electroquímica produciendo trabajo eléctrico. Bajo condiciones reversibles este trabajo iguala el cambio de energía libre y el potencial de la celda se calcula por la integración de la ecuación anteriormente descrita.
Si la reacción transcurriera, el paso de n1 mole de electrones sería acompañando por un incremento de n1 moles de M en una semicelda y cambios complementarios en otra semicelda. Por lo tanto ½ mol de electrones (F/2 Culombios) son suficientes para la mezcla completa de 1.0 mol de M+2, un decrecimiento de n1 moles de M++2+1 en ambas semiceldas.
En este experimento calcularemos el ΔG de mezcla de 1.0 mol de Fe y un mol de Fe+2+3. Se utilizará una celda electroquímica para la obtención de los datos experimentales. Durante la medida de un potencial eléctrico de equilibrio no hay flujo neto de electrones, lo cual implica que las concentraciones de las especies iónicas no varían, es necesario también tener en cada semicelda una especie oxidada y una reducida para que la ecuación de Nernst quede definida.
Por lo tanto, los datos experimentales deben obtenerse con la presencia de las especies oxidadas y reducidas en ambas semiceldas y además las concentraciones deben ser cambiadas por el experimentador.
En la practica el proceso de mezclado no se sigue esperando que el flujo de electrones iguales las concentraciones, si no preparando una serie de soluciones en estados sucesivos del proceso de mezclado. Por ejemplo 10/1, 9/1, 8/1, …. 5/5.
El potencial de la celda decrece a mediad que la mezcla se aproxime al punto de concentraciones iguales.
Si en la ecuación

reemplaza n2 por (1-n1) se obtiene:
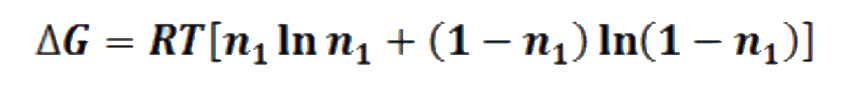
Tanto ΔG1 como ΔG2 y ΔG3 se pueden obtener usando la anterior expresión, por ejemplo, ΔG2 es igual a:

El factor 2 se debe a la suma del trabajo para las dos semiceldas:
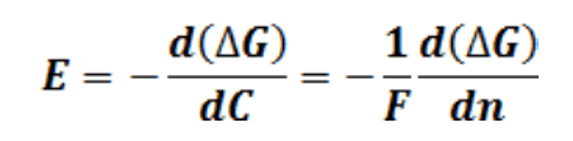
Reemplazando y derivando


Como (1-n1)/n1 es n2/n1 puede verse que E no depende del número total de moles, solo de la relación entre el número de moles o de la relación entre las concentraciones.
Materiales
- 2 balones aforados de 250 mL
- Vidrio de reloj
- 2 buretas de 25 mL
- 2 vasos de 100 mL
- Pinza para bureta
- Puente salino
- Multímetro
- 2 electrodos de grafito
- Cables con pinzas
Reactivos
- Solución de Ferricianuro de potasio 0.10 M
- Solución de Ferrocianuro de potasio 0.10 M
Procedimiento – Entropía y energía libre de mezclas
Se preparan las mezclas para las dos semiceldas de tal forma que en una haya n1 moles por litro de ferrocianuro de potasio y (0.10 – n1) de la otra solución. La otra semicelda tendrá una relación opuesta.
Se sugieren las siguientes relaciones en la concentración de iones Fe+2 /Fe+3 : 99/1, 19/1, 9/1, 8/1, 8/2, 7/3, 6/4, 13/12. Lo importante es variar la relación desde 99/1 hasta 1/1.
Se conectan las dos semiceldas con el puente salino y se lee el potencial a temperatura constante de 30°C

Después del laboratorio
Calcule el potencial de la celda en cada caso y consígnelo en una tabla al igual que el resultado experimental.
Para cada relación de trabajo n2/n1 = (1 – n1)/n1 encuentre la extensión de la mezcla n*. por ejemplo si n2/n1, es 99/1 la extensión de la mezcla n* es 1/100. Si n2/n1 es 19/1 entonces n* es 1/20 etc.
Construya una gráfica de potencial versus extensión de la mezcla, n* usando los datos de potenciales teóricos y experimentales. Del área bajo la curva se puede encontrar la energía libre de Gibbs ΔG2 de acuerdo a la relación

Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Thermodynamics of Mixing – Chemistry LibreTexts
Como citar este artículo:
APA: (2020-05-27). Entropía y energía libre de mezclas. Recuperado de https://quimicafacil.net/manual-de-laboratorio/entropia-y-energia-libre-de-mezclas/
ACS: . Entropía y energía libre de mezclas. https://quimicafacil.net/manual-de-laboratorio/entropia-y-energia-libre-de-mezclas/. Fecha de consulta 2026-02-17.
IEEE: , "Entropía y energía libre de mezclas," https://quimicafacil.net/manual-de-laboratorio/entropia-y-energia-libre-de-mezclas/, fecha de consulta 2026-02-17.
Vancouver: . Entropía y energía libre de mezclas. [Internet]. 2020-05-27 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/entropia-y-energia-libre-de-mezclas/.
MLA: . "Entropía y energía libre de mezclas." https://quimicafacil.net/manual-de-laboratorio/entropia-y-energia-libre-de-mezclas/. 2020-05-27. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net