Estimated reading time: 7 minutos
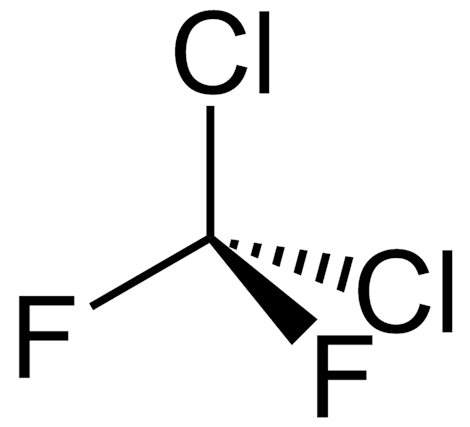
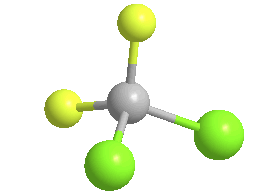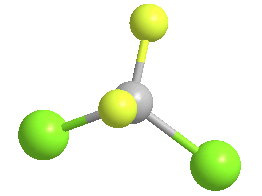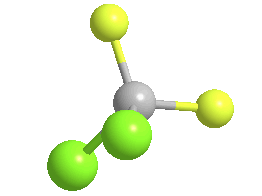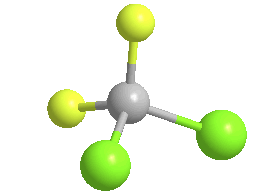
El diclorodifluorometano (R-12) es un gas incoloro que suele venderse bajo la marca Freon-12, y un clorofluorocarbono halometano (CFC) utilizado como refrigerante y propulsor de aerosoles.
En cumplimiento del Protocolo de Montreal, su fabricación se prohibió en los países desarrollados (países no incluidos en el artículo 5) en 1996, y en los países en desarrollo (países incluidos en el artículo 5) en 2010, debido a la preocupación por su efecto perjudicial para la capa de ozono. Su único uso permitido es como retardante del fuego en submarinos y aviones. Es soluble en muchos disolventes orgánicos. Las botellas de R-12 son de color blanco.
Historia del diclorodifluorometano
El diclorodifluorometano es el más utilizado de todos los freones®. Es un gas incoloro y no inflamable que huele a éter en altas concentraciones.
A finales del siglo XIX y principios del XX, el amoníaco (NH3) y el dióxido de azufre (SO2) eran los gases más utilizados en los sistemas de refrigeración. Sin embargo, estas sustancias eran tóxicas e inflamables y su uso provocaba muchas muertes y lesiones. Tres empresas estadounidenses, DuPont, General Motors y Frigidaire, comenzaron a buscar una alternativa no inflamable y no tóxica al amoníaco y al dióxido de azufre en sus productos de refrigeración.
Charles (Boss) Kettering, vicepresidente de General Motors Research Corporation, buscaba un sustituto del refrigerante que fuera incoloro, inodoro, insípido, no tóxico y no inflamable. Reunió a un equipo que incluía a Thomas Midgley, Jr, Albert Leon Henne y Robert McNary. Entre 1930 y 1935, desarrollaron el diclorodifluorometano (CCl2F2 o R12), el triclorofluorometano (CCl3F o R11), el clorodifluorometano (CHClF2 o R22), el triclorotrifluoroetano (CCl2FCClF2 o R113) y el diclorotetrafluoroetano (CClF2CClF2 o R114), a través de Kinetic Chemicals, una empresa conjunta de DuPont y General Motors.
El desarrollo del diclorodifluorometano permitió que los sistemas de refrigeración funcionaran de forma más eficaz y segura. DuPont, que había unido sus fuerzas a las de General Motors en la búsqueda de un nuevo refrigerante, comenzó a fabricar Freon en 1930.
Durante varias décadas, el freón se utilizó ampliamente en la refrigeración y en otras aplicaciones industriales. En la década de 1970, dos científicos de la Universidad de California, F. Sherwood Rowland y Mario Molina, descubrieron que los CFC que escapaban de los aparatos de la superficie de la Tierra ascendían a la estratosfera, donde estaban expuestos a la intensa radiación ultravioleta del Sol. Esta radiación provocaba la descomposición de los CFC en una serie de productos, uno de los cuales era el cloro. El cloro producido en esta descomposición, a su vez, ataca a las moléculas de ozono (O3) de la estratosfera y las convirtió en moléculas normales de oxígeno (O2).
El protocolo de Montreal
Una vez reconocida, esta serie de reacciones se convirtió en un asunto de gran preocupación para los científicos. La capa de ozono absorbe la radiación ultravioleta del Sol, reduciendo el riesgo de cáncer de piel y otros problemas de salud producidos por la radiación ultravioleta. En 1987, veintisiete naciones habían firmado el Protocolo de Montreal relativo a las sustancias que agotan la capa de ozono, que exigía una reducción del 50% de la producción de CFC para el año 2000.
Una enmienda al protocolo adoptada en 1990 fue aún más lejos, prohibiendo la producción de CFC en los países desarrollados. Finalmente, 148 países firmaron el Protocolo de Montreal. En 1996, la producción de CFC se había detenido prácticamente, excepto en algunos países en desarrollo y para su uso en ciertas aplicaciones específicas, como los inhaladores para el asma. Una década después, los científicos informaron de que la capa de ozono había empezado a mostrar signos de recuperación.
Desde que se prohibió la producción de CFC, los fabricantes están sustituyendo los productos Freon® por dos grupos de compuestos relacionados, los hidroclorofluorocarbonos (HCFC) y los hidrofluorocarbonos (HFC). Estos compuestos que contienen hidrógeno son menos eficientes energéticamente que los CFC, pero se consideran más seguros (aunque no del todo) para el medio ambiente.
Síntesis
El diclorodifluorometano se obtiene mediante la reacción del tetracloruro de carbono (CCl4) con el gas fluoruro de hidrógeno (H2F2) en presencia de un catalizador, normalmente el pentafluoruro de antimonio (SbF5). En esta reacción, dos de los cloros presentes en el tetracloruro de carbono se sustituyen por dos fluoros del fluoruro de hidrógeno, produciendo diclorodifluorometano.
Esta reacción también puede producir triclorofluorometano (CCl3F), clorotrifluorometano (CClF3) y tetrafluorometano (CF4).
Usos comunes y riesgos potenciales
El diclorodifluorometano y otros freones se utilizaron en su día para muchas aplicaciones comerciales: como refrigerantes para aires acondicionados y frigoríficos; como propulsor de aerosoles para lacas para el pelo, insecticidas, pinturas, adhesivos y limpiadores; y como agente espumante en la fabricación de plásticos de transporte. Su relativa no toxicidad hizo que estos materiales fueran útiles para la conservación de alimentos e incluso para enfriar copas de cóctel. Otros usos anteriores de los freones son los siguientes:
- Como propulsor de cohetes;
- En disolventes utilizados en la fabricación de pinturas y barnices;
- En la preparación de secciones congeladas de tejidos;
- Para la congelación de alimentos como método de conservación;
- En los sistemas de purificación de agua;
- Como agente de detección de fugas.
Las empresas favorecían los freones para tantos usos porque no son tóxicos ni reactivos en la troposfera. Esta propiedad resultó ser también una desventaja, ya que significa que los freones permanecen en la atmósfera durante periodos de tiempo tan largos que pueden llegar a la estratosfera, donde suponen una grave amenaza para la capa de ozono.
Datos interesantes
En 1930, Thomas Midgley demostró la seguridad del freón® en una reunión de la Sociedad Química Americana inhalando el gas y luego exhalándolo para apagar la llama de una vela.
La producción mundial de diclorodifluorometano pasó de unos 150 millones de kilogramos anuales en 1960 a más de 750 millones de kilogramos anuales en 1990. En 1996, gracias al Protocolo de Montreal, había descendido a menos de 50 millones de kilogramos anuales.
Un átomo de cloro producido en la estratosfera por la descomposición de una molécula de CFC puede destruir 100.000 moléculas de ozono.
Los freones pueden suponer un peligro para la salud si se inhalan en grandes cantidades. Desplazan el oxígeno del aire, provocando mareos, somnolencia, latidos irregulares, paros cardíacos, pérdida de conciencia y muerte por asfixia.
Pulverizados sobre la piel, los freones pueden causar congelación, daño producido por la exposición a temperaturas de congelación. La ignición de los freones también supone un peligro para la salud humana debido a la liberación de gases tóxicos como el cloruro de hidrógeno (HCl), el fluoruro de hidrógeno (H2F2) y el fosgeno (COCl2).
Para más información Dichlorodifluoromethane
Como citar este artículo:
APA: (2022-03-22). Diclorodifluorometano. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/diclorodifluorometano/
ACS: . Diclorodifluorometano. https://quimicafacil.net/compuesto-de-la-semana/diclorodifluorometano/. Fecha de consulta 2026-03-08.
IEEE: , "Diclorodifluorometano," https://quimicafacil.net/compuesto-de-la-semana/diclorodifluorometano/, fecha de consulta 2026-03-08.
Vancouver: . Diclorodifluorometano. [Internet]. 2022-03-22 [citado 2026-03-08]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/diclorodifluorometano/.
MLA: . "Diclorodifluorometano." https://quimicafacil.net/compuesto-de-la-semana/diclorodifluorometano/. 2022-03-22. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net