Síntesis de nitrato de plomo (II)
Actualizado en mayo 22, 2023
Tiempo de lectura estimado: 4 minutos
El nitrato de plomo (II) es un compuesto de apariencia blanca, cristalina y soluble en agua. Era conocida como plumb dulcis en la antigüedad y era empleado para la síntesis de otros compuestos de plomo.
El plomo es el elemento químico mas denso de los que se encuentran en la corteza terrestre, a su vez el suave y altamente maleable. Con un punto de fusión relativamente bajo, es fácil de moldear en diferentes formas. La superficie del plomo tiene un color plateado oscuro con ligeros tonos azules, aunque en contacto con el ambiente, su color cambia rápidamente a un tono gris.
El plomo exhibe dos estados de oxidación; +4 y +2, aunque es más común el estado +2. Es ligeramente no reactivo en comparación de otros elementos cercanos, y algunos de sus compuestos exhiben características anfóteras.
Características del nitrato de plomo
El nitrato de plomo (II) (Pb(NO3)2) junto con el perclorato de plomo (II) trihidratado (Pb(ClO4)2.3H2O) y el acetato de plomo trihidratado (Pb(CH3COO)2.3H2O), son los únicos compuestos de Pb+2 que se disuelven en agua de forma importante a temperatura ambiente, y permiten conocer la química catiónica del Pb+2. Los carbonatos, sulfatos y cromatos de plomo son insolubles e incluso los haluros cloruro de plomo y fluoruro de plomo son solo ligeramente solubles.
Por este motivo, siempre que se filtren compuestos solubles de plomo hay que cuidar que los recipientes en donde se recojan los filtrados estén exentos de iones, como carbonato, sulfato, cloruro entre otros, ya que se pueden formar precipitados y, en dado caso de observar turbidez en el líquido filtrado, proceder a enjuagar y volver a filtrar hasta obtener líquidos claros.
El nitrato de plomo (II) cristaliza en octaedros regulares, es soluble en agua e insoluble en alcohol y se conserva inalterado expuesto al aire. Calentando a 400°C se descompone con formación de óxido de plomo (II), oxígeno y óxido nitroso.
Materiales
- Balón de fondo redondo de 100 mL con cuello esmerilado
- Condensador de bolas
- 2 tubos de ensayo
- Gradilla
- Pinza para tubo de ensayo
- Vaso de precipitado de 250 mL
- Vaso de precipitado de 500 mL
- Probeta de 100 mL
- Pipeta graduada de 10 mL
- Propipeta o pipeteador
- Embudo de vidrio
- Pipetas Pasteur
- Plancha de calentamiento
- Sistema de filtración al vacío
- Papel de filtración
- Capsula de porcelana mediana
- Soporte universal
- Pinzas con nuez
- Aceite mineral
- Agitador magnético
Reactivos
- Ácido nítrico concentrado
- Plomo en granallas
- Solución de Carbonato de sodio saturada
- Amoniaco
- Ácido acético concentrado
- Solución de Cromato de sodio al 10%
- Etanol
Procedimiento – Síntesis de nitrato de plomo (II)
Tiempo necesario: 1 hora
Síntesis de nitrato de plomo (II)
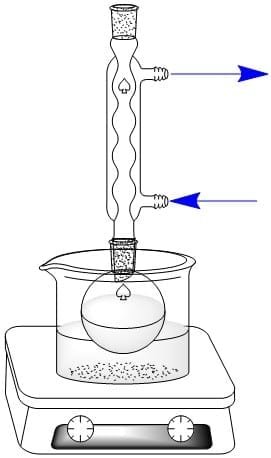
En un balón de fondo redondo de 100 mL colocar 7 g de plomo en granallas, 15 mL de ácido nítrico y 30 mL de agua. Realizar el montaje de reflujo con calentamiento a baño de María con aceite mineral que se muestra a continuación y calentar con agitación hasta la desaparición del plomo.

Finalizada la reacción, dejar enfriar un poco el conjunto y filtrar en un embudo de placa filtrante.
El liquido obtenido se coloca en una capsula de porcelana y calentar en una plancha de calefacción a temperatura media en una campana de extracción de gases.
Dejar evaporar el solvente y cristalizar. Separar los cristales por filtración.
Recristalizar el nitrato de plomo (II) obtenido agregando la cantidad de agua mínima de agua caliente y filtrando (consultar la solubilidad del nitrato de plomo en agua caliente). Pesar el producto obtenido.
Disolver los cristales de producto en 10 mL de agua. Separar 5 mL de la solución obtenida y adicionar solución saturada de carbonato de sodio hasta la formación de un precipitado blanco. Filtrar el precipitado y lavar con agua caliente y posteriormente con etanol. Dejar secar al aire.
A los otros 5 mL de solución, adicionar gota a gota amoniaco hasta que el pH de la solución sea neutro. Si se observa la formación de un precipitado agregar ácido acético hasta su disolución.
Agregar solución de cromato de sodio al 10% gota a gota hasta que no se forme mas precipitado.
Filtrar el producto obtenido lavando con agua caliente y después con etanol. Dejar secar al ambiente.
Después del experimento
Escribir las reacciones realizadas en el experimento. Calcular el rendimiento de la reacción de síntesis de nitrato de plomo (II). Identificar los productos obtenidos en la reacción y en la caracterización del producto.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Mayor información
Clasificación
Nivel: Universitario
Tipo: Practica de enseñanza
Riesgo: medio
Como citar este artículo:
APA: (2019-12-18). Síntesis de nitrato de plomo (II). Recuperado de https://quimicafacil.net/manual-de-laboratorio/sintesis-nitrato-plomo-ii/
ACS: . Síntesis de nitrato de plomo (II). https://quimicafacil.net/manual-de-laboratorio/sintesis-nitrato-plomo-ii/. Fecha de consulta 2024-04-19.
IEEE: , "Síntesis de nitrato de plomo (II)," https://quimicafacil.net/manual-de-laboratorio/sintesis-nitrato-plomo-ii/, fecha de consulta 2024-04-19.
Vancouver: . Síntesis de nitrato de plomo (II). [Internet]. 2019-12-18 [citado 2024-04-19]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/sintesis-nitrato-plomo-ii/.
MLA: . "Síntesis de nitrato de plomo (II)." https://quimicafacil.net/manual-de-laboratorio/sintesis-nitrato-plomo-ii/. 2019-12-18. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net