Química de los alcanos
Actualizado en octubre 24, 2022
Tiempo de lectura estimado: 6 minutos
- Materiales
- Reactivos
- Procedimiento
- Después del laboratorio
En química orgánica, un alcano, o parafina (un nombre histórico trivial que también tiene otros significados), es un hidrocarburo saturado acíclico. En otras palabras, un alcano está formado por átomos de hidrógeno y carbono dispuestos en una estructura de árbol en la que todos los enlaces carbono-carbono son sencillos. Los alcanos tienen la fórmula química general CnH2n+2. Los alcanos varían en complejidad desde el caso más simple del metano (CH4), donde n = 1 (a veces llamada molécula madre), hasta moléculas arbitrariamente grandes y complejas, como el pentacontano (C50H102) o el 6-etil-2-metil-5-(1-metiletil) octano, un isómero del tetradecano (C14H30).
La Unión Internacional de Química Pura y Aplicada (IUPAC) define los alcanos como «hidrocarburos acíclicos ramificados o no ramificados que tienen la fórmula general CnH2n+2, y que, por tanto, están formados totalmente por átomos de hidrógeno y átomos de carbono saturados». Sin embargo, algunas fuentes utilizan el término para designar cualquier hidrocarburo saturado, incluidos los que son monocíclicos (es decir, los cicloalcanos) o policíclicos, a pesar de que tienen una fórmula general distinta (los cicloalcanos son CnH2n).
Los alcanos son compuestos en los que el carbono está hibridado sp3, por lo que forman fuertes enlaces s. Las moléculas de un alcano tienen una disposición tetraédrica con ángulos de 109,5°.
Los alcanos son gaseosos de C1 a C4, líquidos de C5 a C16 y sólidos a partir de C17.
Materiales
- Mortero y pistilo
- Tubos de ensayo
- Mechero Bunsen
- Capsula de porcelana
- Varillas de vidrio
- Vasos de precipitados de 100 mL
- Probeta graduada de 250 mL
- Pipeta graduada de 10 mL
- Propipeta o pipeteador
Reactivos
- Hexano
- Gasolina
- Parafina
- Metano*
- Permanganato de potasio sol. 0,001 M
- Hidróxido de sodio en perlas y sol. 4 M
- Acetato de sodio
- Ácido sulfúrico sol. 1:5
- Agua de bromo saturada
- Benceno
- Cloroformo
- Tetracloruro de carbono
- Yodo
- Sacarosa
- Cloruro de sodio
- Hidróxido de bario sol. 1 %
- Etanol
* La fuente de metano más segura y fácil de manejar en los laboratorios modernos es una botella de gas comprimido. En caso de no contar con este se puede generar por la primera reacción para su estudio.
Procedimiento
Parte 1: Preparación de metano a partir de acetato de sodio e hidróxido de sodio
En un pequeño mortero mezclar 1 g de acetato de sodio y 1 g de hidróxido de sodio, pulverizándolos bien. La mezcla se recoge en un tubo de ensayo y se calienta con un mechero bunsen. Cuando se completa la reacción, se libera metano del tubo de ensayo. El gas puede ser reconocido por la combustión. La reacción es la siguiente:
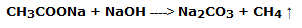
Segunda parte: Reacciones de combustión de alcanos:
2.1 – Combustión de metano:
Encender un mechero Bunsen, alimentado con metano, con una llama no sensible y colocar sobre éste un vaso de precipitados de 250 ml. volcado, perfectamente limpio y seco. Al poco tiempo, podemos observar la condensación en las paredes del vidrio del vapor de agua y el depósito de partículas de carbono (negro de humo). En la falta de oxígeno, de hecho, pueden ocurrir dos reacciones. La primera es:

temperatura < 800 °C
sólo se produce la oxidación del carbono del hidrocarburo a monóxido de carbono.
En el segundo,

temperatura < 800 °C
se oxida sólo a carbono elemental.
Al abrir los orificios de entrada de aire del mechero bunsen se produce un silbido en la llama. Colocando otro vaso de precipitados seco sobre la llama sólo se observa la condensación del vapor de agua. En este caso se ha producido la oxidación completa del carbono a dióxido de carbono, con la reacción

temperatura > 900 °C
La formación de dióxido de carbono puede detectarse con gran dificultad colocando una varilla de vidrio humedecida con una solución de hidróxido de bario sobre la llama bunsen. Esto se verá ligeramente enturbiado por la formación de carbonato de bario insoluble. La formación de negro de humo puede ser más evidente si se utiliza una cápsula de porcelana blanca en lugar de un vaso de precipitados.
Tercera parte: verificación de la baja reactividad
3.1) – Reactividad del metano
Se vierten unos 10 mL de agua de bromo en un vaso de precipitados y se diluyen con 50 mL de agua destilada. Mediante una cánula de vidrio, se hace burbujear lentamente el metano en la solución. Como no se observa ningún cambio en el color de la solución, se deduce que el bromo no ha sufrido ninguna reducción y el metano, en consecuencia, no se ha oxidado.
3.2)- Reactividad del hexano
En tres tubos de ensayo se colocan 1 o 2 mL de permanganato potásico sol. 0,001 M. En un tubo de ensayo añade unas gotas de sol de hidróxido de sodio. 4 M; en otro, unas gotas de ácido sulfúrico sol. 1:5.
A los tres tubos de ensayo se añade aproximadamente 1 mL de hexano, se agita y se observa que en ningún caso se produce la decoloración del permanganato potásico; esto indica que en condiciones neutras, básicas o ácidas no se ha producido la reducción del Mn7+ con la consiguiente oxidación del alcano.
Cuarta parte: pruebas comparativas de miscibilidad y solubilidad de alcanos
Disponiendo de varios alcanos o sus derivados (por ejemplo, tetracloruro de carbono, cloroformo) es posible realizar pruebas para verificar la miscibilidad de estos compuestos. Estas pruebas pueden realizarse también con otros disolventes apolares (por ejemplo, benceno) o polares (por ejemplo, agua, etanol).
Las pruebas de solubilidad pueden realizarse disolviendo un alcano sólido (parafina) en uno líquido y tratando de disolver en el mismo sustancias de tipo molecular (por ejemplo, yodo, sacarosa) o iónico (por ejemplo, cloruro de sodio).
Los resultados de las pruebas anteriores pueden recogerse en un cuadro sinóptico especialmente preparado.
Nota: En ausencia de hexano, las pruebas anteriores pueden realizarse con gasolina que es una mezcla de hidrocarburos con 6-7-8 átomos de carbono.
Después del laboratorio
Investigar métodos alternativos de preparación de alcanos a escala laboratorio
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información 12.7 Chemical Properties of Alkanes
Como citar este artículo:
APA: (2021-11-10). Química de los alcanos. Recuperado de https://quimicafacil.net/manual-de-laboratorio/quimica-de-los-alcanos/
ACS: . Química de los alcanos. https://quimicafacil.net/manual-de-laboratorio/quimica-de-los-alcanos/. Fecha de consulta 2024-04-18.
IEEE: , "Química de los alcanos," https://quimicafacil.net/manual-de-laboratorio/quimica-de-los-alcanos/, fecha de consulta 2024-04-18.
Vancouver: . Química de los alcanos. [Internet]. 2021-11-10 [citado 2024-04-18]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/quimica-de-los-alcanos/.
MLA: . "Química de los alcanos." https://quimicafacil.net/manual-de-laboratorio/quimica-de-los-alcanos/. 2021-11-10. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net