Alcalimetría y acidimetría
Actualizado en enero 8, 2024
Tiempo de lectura estimado: 8 minutos
Las técnicas de análisis de alcalimetría y acidimetría son métodos de análisis cuantitativos y volumétricos empleados en varias ramas de la química, pero con especial énfasis en química analítica. Estos métodos son recíprocos entre sí, la alcalimetría estima la basicidad de una solución y por su parte la acidimetría hace lo propio con la acidez. En ambos métodos, se utilizan los mismos procedimientos e instrumental.
Las soluciones con pH básico (> 7.0), suelen ser soluciones de los óxidos, hidróxidos, o carbonatos del grupo de los alcalinos. Estos juegan el papel de bases fuertes, siendo bastante solubles en agua. Un ejemplo típico es el amoníaco.
En el laboratorio, para llevar a cabo los análisis la acidimetría y la alcalimetría, siempre se parte de soluciones ácidas o alcalinas de concentración conocida, que sirven de patrón, para así poder determinar la concentración.
Para la elaboración de soluciones patrón se parte de los cálculos estequiométricos y la concentración final se corrige con el uso de patrones primarios. Cuando la concentración de la solución se ha corregido, se convierte en un estándar secundario, que puede ser empleado para la estimación de la concentración de otras soluciones.
Con respecto a los indicadores, pueden ser clasificados clasificarlos en neutros, sensibles a los ácidos, e indicadores sensibles a las bases. Cuando son usados en agua pura, los indicadores de tipo neutro tomaran el color de transición; los indicadores sensibles a los ácidos tomaran el color ácido correspondiente, y, por último, los sensibles a las bases, tendrán el color alcalino.
Estándares primarios
Un estándar o patrón primario es una sustancia que debe ser altamente ionizable, no volátil ni oxidante, muy estable al aire (no debe ser higroscópica en exceso ni delicuescente), de alto peso molecular perfectamente definido y debe permitir su secado a 100-110°C sin descomponerse.
El estándar o patrón primario más común en el laboratorio es el biftalato de potasio o ftalato ácido de potasio, cuyo peso molecular es 204,22 g. Para la valoración de hidróxido de sodio, se parte de una cantidad conocida de biftalato de potasio, la cual se titula entonces contra la solución desconocida de hidróxido de sodio, utilizando como indicador fenolftaleína. En el punto final de valoración, cuando la solución cambie de incoloro a rosado, se tendrá la siguiente igualdad:
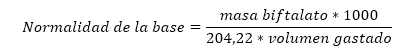
¿Cuales son los estándares primarios?
Algunos ejemplos de estándares primarios son:
- Trióxido de arsénico para la fabricación de una solución de arsenito de sodio para la normalización de una solución de periodato de sodio
- Ácido benzoico para la estandarización de soluciones básicas sin agua: hidróxido de sodio y potasio etanólico, TBAH y metanolatos alcalinos en metanol, isopropanol o DMF
- Bromato de potasio (KBrO3) para la estandarización de soluciones de tiosulfato de sodio
- Ftalato ácido de potasio (generalmente llamado KHP) para la normalización de la base acuosa y el ácido perclórico en soluciones de ácido acético
- Carbonato de sodio para la normalización de los ácidos acuosos: soluciones de ácido clorhídrico, ácido sulfúrico y ácido nítrico (pero no ácido acético)
- Cloruro de sodio para la estandarización de soluciones de nitrato de plata
- Ácido sulfanílico para la estandarización de soluciones de nitrito de sodio
- Polvo de zinc, después de ser disuelto en ácido sulfúrico o clorhídrico, para la estandarización de soluciones de EDTA
Materiales
Los materiales para la práctica de alcalimetría y acidimetría son
- Balanza analítica
- Vidrio de reloj
- Espátula pequeña
- Soporte Universal
- Pinzas para bureta
- Bureta de 25 mL con llave de teflón
- Estufa de laboratorio
- Desecador
- Pinzas cortas para crisol
- Pipetas aforadas de 1, 10 y 25 mL
- Balones aforados de 100 y 250 mL
- Erlenmeyer de 250 mL
- Vasos precipitados de 50 y 250 mL
- Frasco lavador
Reactivos
Los reactivos necesarios para la práctica son
- Biftalato de potasio R.A.
- Hidróxido de sodio R.A.
- Ácido clorhídrico R.A.
- Solución alcohólica de fenolftaleína al 1%.
Procedimiento alcalimetría y acidimetría
Estandarización de una solución de hidróxido de sodio – alcalimetría

- Realizar los cálculos estequiométricos para estimar la masa necesaria de hidróxido de sodio para preparar 250 mililitros de una solución 0,1 M. Preparar la solución pesando la cantidad estimada de hidróxido grado Reactivo analítico en un vidrio de reloj limpio y seco y transfiriendo de manera cuantitativa a un balón aforado de 1 litro que contiene previamente 50 mL de agua destilada, agitar para disolver el hidróxido y lleva a aforo.
- Pesar en balanza analítica, utilizando un vidrio de reloj o un vaso de precipitados de 50 mL, 0,25 g del biftalato de potasio, grado Reactivo Analítico (R.A.), previamente secado a 100–110°C y conservado dentro de un desecador. Registrar el peso exacto en el cuaderno de laboratorio.
- Transferir de manera cualitativa el biftalato pesado a un erlenmeyer de 250 mL, ayudándose con un frasco lavador y añadir alrededor de 100 mL de agua destilada, agitando suavemente hasta su disolución. Agregar 2 gotas de solución de fenolftaleína.
- Realizar el montaje mostrado a continuación. Purgar y llenar la bureta con la solución recién preparada de hidróxido de sodio, enrasando a cero.
Titular la solución de biftalato hasta obtener una coloración rosa que persista 30 segundos, lo cual indica que la reacción de neutralización ha llegado a su fin. Registrar el volumen de NaOH gastado.
Repetir el procedimiento dos veces más para obtener un volumen promedio de hidróxido de sodio gastado.
Determinación de la normalidad de una solución de ácido clorhídrico – acidimetría
- Teniendo en cuenta los valores consignados en la siguiente tabla, tomar una alícuota de ácido clorhídrico de concentración desconocida.

- Medir el valor indicado de ácido clorhídrico y llevarlo a un erlenmeyer.
- Adicionar al ácido 50 mL de agua destilada y 3 gotas de fenolftaleína, mezclar bien.
- Realizar el montaje de titulación como el mostrado anteriormente con una bureta limpia. Llenar la bureta hasta el enrase con la solución estandarizada anteriormente de hidróxido de sodio.
- Colocar el erlenmeyer debajo de la bureta y agregar lentamente desde ésta el hidróxido de sodio, hasta que la solución de ácido clorhídrico cambie a color rosado pálido y permanezca el color; lo cual indica que la reacción de neutralización ha llegado a su fin.
- Repetir tres veces este procedimiento para verificar el volumen de hidróxido de sodio gastado
- Promediar los volúmenes de hidroxido gastados en las tres titulaciones para cada volumen de ácido clorhídrico.
- Completar la siguiente tabla con los valores de volumen promedio de hidróxido de sodio gastados

Cálculos de alcalimetría y acidimetría
Tomando los valores promedios de masa de biftalato de potasio empleado para la estandarización de hidróxido de sodio y los valores promedios de solución de hidróxido gastados, calcular la normalidad del hidróxido de sodio. Este será el valor de concentración de la solución de hidróxido como estándar secundario para la valoración por acidimetría.
Método grafico para acidimetría
Se puede emplear un método grafico para estimar la concentración de una solución de acido a partir de una solución estandarizada de base o hidróxido.
Con los datos de la segunda tabla, graficar en una hoja de papel milimetrado el volumen de base o hidróxido (en el eje X) vs volumen de ácido (en el eje Y). Se obtiene la gráfica de una recta con la siguiente ecuación y=mx.
en donde Y = Volumen de ácido y X = Volumen de base
La pendiente de esta gráfica (m) corresponde matemáticamente a la normalidad del ácido, de acuerdo con Vac = mVb
Hallando la pendiente se determina la normalidad del ácido, lo cual se puede hacer por el método de mínimos cuadrados o algún otro método numérico.
Después del laboratorio
En el presente experimento se usaron tanto un hidróxido como un ácido monopróticos (liberan solo un H+ o un OH–), ¿Qué ajustes a los cálculos se debe realizar para el caso en que se necesite valorar un ácido diprótico como el ácido sulfúrico o triprótico como el ácido fosfórico?
Para las valoraciones se empleó fenolftaleína como indicador, ¿que otro indicador se podría haber utilizado? ¿Qué características debe cumplir un indicador para ser empleado en alcalimetría y acidimetría?
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información CHE-2211 Lecture 19: Acid-base volumetry – OneClass
Como citar este artículo:
APA: (2020-08-19). Alcalimetría y acidimetría. Recuperado de https://quimicafacil.net/manual-de-laboratorio/alcalimetria-y-acidimetria/
ACS: . Alcalimetría y acidimetría. https://quimicafacil.net/manual-de-laboratorio/alcalimetria-y-acidimetria/. Fecha de consulta 2024-04-19.
IEEE: , "Alcalimetría y acidimetría," https://quimicafacil.net/manual-de-laboratorio/alcalimetria-y-acidimetria/, fecha de consulta 2024-04-19.
Vancouver: . Alcalimetría y acidimetría. [Internet]. 2020-08-19 [citado 2024-04-19]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/alcalimetria-y-acidimetria/.
MLA: . "Alcalimetría y acidimetría." https://quimicafacil.net/manual-de-laboratorio/alcalimetria-y-acidimetria/. 2020-08-19. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net