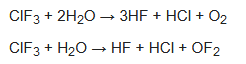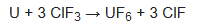Tiempo de lectura estimado: 9 minutos
El trifluoruro de cloro es un compuesto interhalógeno con la fórmula ClF3. Este gas incoloro, venenoso, corrosivo y extremadamente reactivo se condensa en un líquido amarillo verdoso pálido, la forma en la que se vende más a menudo (presurizado a temperatura ambiente).
El compuesto es de interés principalmente como componente de los combustibles para cohetes, en las operaciones de limpieza y grabado sin plasma en la industria de los semiconductores, en el procesamiento de combustible para reactores nucleares, y otras operaciones industriales.
Algo muy peligroso
Venenoso, corrosivo, extremadamente reactivo: tres palabras que hacen que cualquier químico se lo piense dos veces. Combinadas, estas propiedades forman un peligroso cóctel. El trifluoruro de cloro, es todas estas cosas y más.
Como un increíblemente fuerte agente oxidante y fluorizante, el trifluoruro de cloro es extremadamente reactivo con la mayoría de los materiales, incluyendo el agua, el vidrio, el amianto y los desprevenidos ingenieros de pruebas. De hecho, es capaz de quemar muchos materiales que de otra manera no serían inflamables sin necesidad de una fuente de ignición. El trifluoruro de cloro es capaz de quemar cosas que normalmente se considerarían ya quemadas hasta el infierno y desaparecidas, y una consecuencia práctica de ello es que empezará a provocar reacciones rugientes con cosas como ladrillos y azulejos de amianto.
¡El concreto estaba en llamas!
Debido a su extrema reactividad, las únicas sustancias capaces de contener trifluoruro de cloro son: acero, cobre y níquel. La formación de una fina capa de fluoruro metálico insoluble los protege de la corrosión, pero si se frota o se derrite el material se quemará inevitablemente.
En los años 50, un contenedor de acero que contenía una tonelada de trifluoruro de cloro se partió, derramando todo su contenido sobre el suelo de hormigón. El producto químico reaccionó instantáneamente, comiendo treinta centímetros de hormigón y otros noventa centímetros de grava debajo, mientras que los humos nocivos «corroían severamente todo lo que estaba expuesto». En palabras de un testigo ocular: «¡El hormigón estaba en llamas!
Pero el hormigón no es la única cosa que se ha vuelto insignificante por este aterrador producto químico. El trifluoruro de cloro es capaz de encender el tejido humano con facilidad. La reacción de hidrólisis con el agua es tan violenta que una quemadura térmica ocurre inmediatamente al contacto. Sin embargo, la quemadura térmica es la menor de sus preocupaciones.
Los productos de la hidrólisis – ácido fluorhídrico y clorhídrico – son ambos intensamente corrosivos. El ácido fluorhídrico se absorbe a través de la piel, por lo que ataca selectivamente al hueso e interfiere con la función nerviosa, causando a menudo una intoxicación mortal por flúor. En 1994, un técnico de laboratorio australiano tuvo la mala suerte de derramar unos cien mililitros de ácido fluorhídrico en su laboratorio, salpicando ambos muslos. A pesar de lavar inmediatamente la zona y sumergirse en agua hasta que llegó la ambulancia, su estado se deterioró hasta el punto de que hubo que amputarle la pierna derecha. A pesar de esto, murió de un fallo múltiple de órganos quince días después del derrame. Comparado con eso, el ácido clorhídrico parece un poco más suave, pero cuidado, aun así te quemará un buen trozo de tu brazo.
Investigación como arma de guerra
Esta propiedad de quemar carne era muy deseada por los nazis. En el período previo a la segunda guerra mundial, el trifluoruro de cloro fue investigado por sus propiedades militares por investigadores del Instituto Kaiser Wilhelm en Alemania, antes de que se comenzara a fabricar en un búnker de alto secreto.
Dado el nombre en clave N-Stoff, planeaban usarlo como arma incendiaria de doble propósito y gas venenoso. Sin embargo, antes de que los nazis pudieran refinarlo hasta el punto de que no matara a sus tropas ni a las de los aliados, el laboratorio fue capturado por el Ejército Rojo – previniendo potencialmente uno de los crímenes de guerra más atroces jamás cometidos.
Preparación, estructura y propiedades del trifluoruro de cloro
La síntesis de trifluoruro de cloro fue reportada por primera vez en 1930 por Ruff y Krug quienes lo prepararon por medio de la fluorización del cloro; esto también produjo ClF y la mezcla fue separada por destilación.
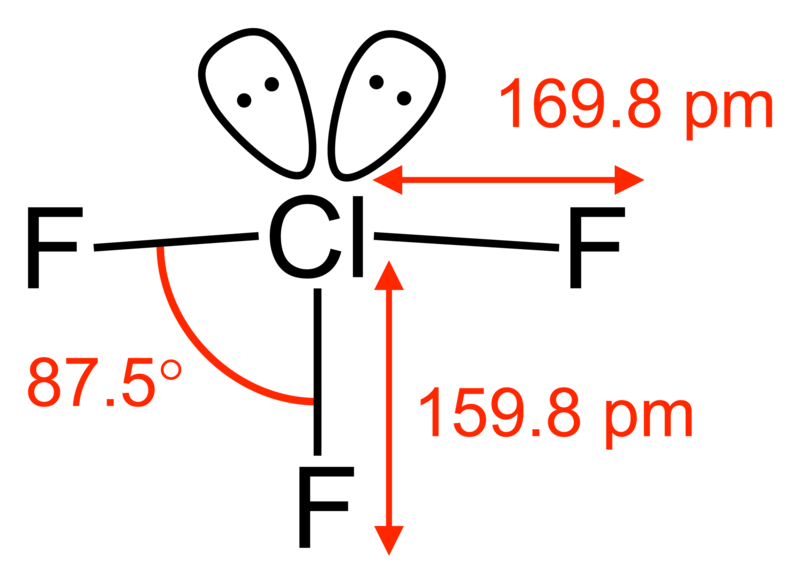
La geometría molecular de la ClF3 tiene aproximadamente forma de T, con un enlace corto (1.598 Å) y dos enlaces largos (1.698 Å). Esta estructura concuerda con la predicción de la teoría VSEPR, que predice que los pares solitarios de electrones ocupan dos posiciones ecuatoriales de una hipotética bipirámide trigonal. Los enlaces axiales alargados Cl-F son consistentes con el enlace hipervalente.
El ClF3 puro es estable hasta 180 °C en recipientes de cuarzo; por encima de esta temperatura se descompone por un mecanismo de radicales libres a sus elementos constituyentes.
Reacciones
Las reacciones con muchos metales dan cloruros y fluoruros; el fósforo produce tricloruro de fósforo (PCl3) y pentafluoruro de fósforo (PF5); y el azufre produce dicloruro de azufre (SCl2) y tetrafluoruro de azufre (SF4). El ClF3 también reacciona violentamente con el agua, oxidándola para dar oxígeno o, en cantidades controladas, difluoruro de oxígeno (OF2), así como fluoruro de hidrógeno y cloruro de hidrógeno:
También convertirá muchos óxidos metálicos en haluros metálicos y oxígeno o difluoruro de oxígeno.
Se produce como un ligando en el complejo CsF(ClF3)3.
Uno de los principales usos del ClF3 es producir hexafluoruro de uranio, UF6, como parte del procesamiento y reprocesamiento del combustible nuclear, mediante la fluoración del uranio metálico:
El compuesto también puede disociarse bajo el esquema:
Usos del trifluoruro de cloro
Industria de semiconductores
En la industria de los semiconductores, el trifluoruro de cloro se utiliza para limpiar las cámaras de deposición de vapores químicos. A diferencia de la mayoría de los productos químicos alternativos utilizados en esta función, no es necesario activarlo mediante el uso de plasma, ya que el calor de la cámara es suficiente para hacer que se descomponga y reaccione con el material semiconductor.
Propulsor de cohetes
Se ha investigado el trifluoruro de cloro como un oxidante almacenable de alto rendimiento en los sistemas de propulsión de cohetes. Sin embargo, la preocupación por el manejo limita severamente su uso. John Drury Clark resumió las dificultades:
Es, por supuesto, extremadamente tóxico, pero ese es el menor de los problemas. Es hipergólico con todos los combustibles conocidos, y tan rápidamente hipergólico que nunca se ha medido ningún retraso en la ignición. También es hipergólico con cosas como la tela, la madera y los ingenieros de pruebas, sin mencionar el asbesto, la arena y el agua, con los que reacciona explosivamente. Puede mantenerse en algunos de los metales estructurales ordinarios -acero, cobre, aluminio, etc.- debido a la formación de una fina película de fluoruro metálico insoluble que protege la mayor parte del metal, así como la capa invisible de óxido sobre el aluminio evita que se queme en la atmósfera. Sin embargo, si esta capa se derrite o se frota, y no tiene oportunidad de reformarse, el operador se enfrenta al problema de hacer frente a un incendio de metal-flúor. Para hacer frente a esta situación, siempre he recomendado un buen par de zapatillas.
El descubrimiento del pentafluoruro de cloro hizo que el ClF3 quedara obsoleto como posible oxidante de combustible para cohetes, pero era igual o incluso más peligroso de fabricar, almacenar y utilizar. Ninguno de los dos compuestos se ha utilizado en ningún sistema oficial de propulsión de cohetes.
Peligros
El trifluoruro de cloro es un agente oxidante y fluorizante muy fuerte. Es extremadamente reactivo con la mayoría de los materiales inorgánicos y orgánicos, como el vidrio, e iniciará la combustión de muchos materiales que de otra manera no serían inflamables sin ninguna fuente de ignición.
Estas reacciones son a menudo violentas, y en algunos casos explosivas. Los recipientes hechos de acero, cobre o níquel no son consumidos por el ClF3 porque se formará una fina capa de fluoruro metálico insoluble, pero el molibdeno, el tungsteno y el titanio forman fluoruros volátiles y, por consiguiente, no son adecuados. Cualquier equipo que entre en contacto con el trifluoruro de cloro debe ser limpiado meticulosamente y luego pasivado, porque cualquier contaminación que quede puede quemar a través de la capa de pasivación más rápido de lo que puede volver a formarse. También se sabe que el trifluoruro de cloro corroe materiales que de otro modo se sabe que no son corrosivos, como el iridio, el platino y el oro.
El hecho de que su capacidad de oxidación supere a la del oxígeno conduce a la corrosividad contra los materiales que contienen óxido, que a menudo se consideran incombustibles. Se ha informado de que el trifluoruro de cloro y gases como éste encienden la arena, el amianto y otros materiales altamente ignífugos.
También encenderá las cenizas de materiales que ya han sido quemados en oxígeno. En un accidente industrial, un derrame de 900 kg de trifluoruro de cloro se quemó a través de 30 cm de hormigón y 90 cm de grava debajo.
Hay solo un método conocido de control/supresión de incendios capaz de hacer frente al trifluoruro de cloro: el uso de nitrógeno y gases nobles: el área circundante debe ser inundada con nitrógeno o argón. A excepción de eso, el área debe simplemente mantenerse fría hasta que la reacción cese. El compuesto reacciona con supresores a base de agua, y se oxida incluso en ausencia de oxígeno atmosférico, haciendo ineficaces los supresores tradicionales de desplazamiento de la atmósfera como el CO2 y el halón. Enciende el vidrio al contacto.
La exposición a mayores cantidades de trifluoruro de cloro, en forma líquida o gaseosa, enciende los tejidos vivos. La reacción de hidrólisis con el agua es violenta y la exposición resulta en una quemadura térmica. Los productos de la hidrólisis son principalmente ácido fluorhídrico y ácido clorhídrico, normalmente liberados como vapor ácido o vapor debido a la naturaleza altamente exotérmica de la reacción.
Para más información Chlorine trifluoride
Como citar este artículo:
APA: (2021-08-31). Trifluoruro de cloro. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/trifluoruro-de-cloro/
ACS: . Trifluoruro de cloro. https://quimicafacil.net/compuesto-de-la-semana/trifluoruro-de-cloro/. Fecha de consulta 2026-03-06.
IEEE: , "Trifluoruro de cloro," https://quimicafacil.net/compuesto-de-la-semana/trifluoruro-de-cloro/, fecha de consulta 2026-03-06.
Vancouver: . Trifluoruro de cloro. [Internet]. 2021-08-31 [citado 2026-03-06]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/trifluoruro-de-cloro/.
MLA: . "Trifluoruro de cloro." https://quimicafacil.net/compuesto-de-la-semana/trifluoruro-de-cloro/. 2021-08-31. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net