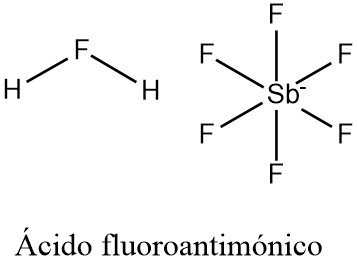
Ácido fluoroantimónico
Actualizado en julio 29, 2021
El ácido fluoroantimónico es un compuesto inorgánico con la fórmula química H2FSbF6 (también escrito H2F[SbF6], 2HF-SbF5, o simplemente HF-SbF5). Es un ácido extremadamente fuerte, fácilmente calificable como superácido.
La función de acidez de Hammett, H0, ha sido medida para diferentes proporciones de HF:SbF5. Mientras que el H0 del HF puro es de -15, la adición de sólo 1 mol % de SbF5 lo reduce a alrededor de -20. Sin embargo, una mayor adición de SbF5 resulta en retornos rápidamente decrecientes, con el H0 alcanzando -21 a 10 mol %. El uso de una base extremadamente débil como indicador muestra que el H0 más bajo alcanzable, incluso con > 50 mol % de SbF5, se encuentra en algún punto entre -21 y -23.
Preparación del ácido fluoroantimónico
La composición «canónica» del ácido fluoroantimónico se obtiene tratando el fluoruro de hidrógeno líquido (HF) con pentafluoruro de antimonio líquido (SbF5) en una relación estequiométrica de 2:1.
Es el superácido más fuerte basado en el valor H0 medido. Sólo los ácidos carboranos, cuyo H0 no se pudo determinar directamente debido a sus altos puntos de fusión, pueden ser ácidos más fuertes que el ácido fluoroantimónico. Se ha demostrado que incluso los hidrocarburos protonan para permitir carbocationes pentacoordinados (iones de carbono). Es excepcionalmente corrosivo y sólo se puede almacenar en contenedores forrados de teflón.
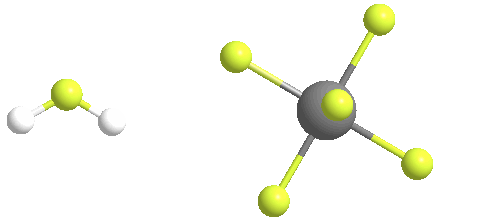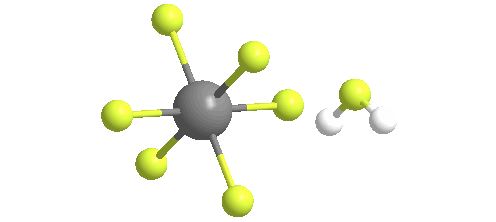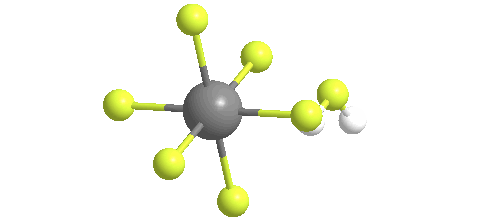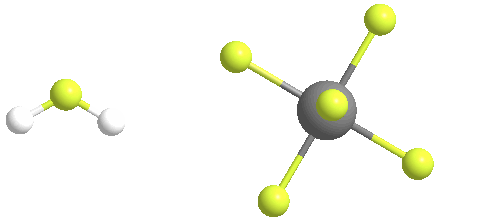
El ácido fluoroantimónico se descompone térmicamente cuando se calienta, generando fluoruro de hidrógeno gaseoso y pentafluoruro de antimonio líquido. A temperaturas tan bajas como 40 C, el ácido fluoroantimónico liberará HF en la fase gaseosa. El pentafluoruro de antimonio líquido puede recuperarse del ácido fluoroantimónico calentándolo y liberando HF en la fase gaseosa
La reacción para producir ácido fluoroantimónico da como resultado la formación del ión fluoronio como una especie principal en equilibrio:

Sin embargo, la especiación del «ácido fluoroantimónico» es compleja y consiste en una mezcla de protones disueltos en HF, [(HF)nH]+ (p. ej., H3F2+), y de SbF5-adductos de flúor (p. ej., Sb4F21-). Así pues, la fórmula «[H2F]+SbF6–» es una aproximación conveniente pero demasiado simplificada de la verdadera composición.
Comportamiento ácido
No obstante, la extrema acidez de esta mezcla es evidente por la capacidad excepcionalmente pobre de aceptación de protones de las especies presentes en la solución (el fluoruro de hidrógeno, del que normalmente no se piensa que tenga ninguna basicidad apreciable de Brønsted, es de hecho la base Brønsted más fuerte de la mezcla).
Como resultado, se suele decir que el ácido contiene «protones desnudos», aunque los protones «libres» están, de hecho, siempre unidos a las moléculas de fluoruro de hidrógeno. Es el ion fluoronio el que explica la extrema acidez del ácido fluoroantimónico. Los protones migran fácilmente a través de la solución, pasando del H2F+ al HF, cuando está presente, por el mecanismo de Grotthuss:

Las fuentes a menudo confunden el valor H0 del ácido fluoroantimónico con su pKa. El valor H0 mide la capacidad de protonación de la masa, el ácido líquido, y este valor ha sido directamente determinado o estimado para varias composiciones de la mezcla. El pKa, por otra parte, mide el equilibrio de la disociación de los protones de una especie química discreta cuando se disuelve en un disolvente determinado.
Dado que el ácido fluoroantimónico no es una sola especie química, su valor de pKa no está bien definido. La acidez en fase gaseosa (GPA) de las especies individuales presentes en la mezcla se ha calculado utilizando métodos de la teoría funcional de la densidad (Los pKas en fase de solución de estas especies pueden, en principio, estimarse teniendo en cuenta las energías de disolución, pero no parece que se informe en la literatura a partir de 2019).
Por ejemplo, se estimó que el par de iones [H2F]+-SbF6– tenía un GPA de 254 kcal/mol. A modo de comparación, el ácido trifílico superácido, el TfOH, es un ácido sustancialmente más débil según esta medida, con un GPA de 299 kcal/mol. Sin embargo, ciertos superácidos de carborano tienen GPAs más bajos que el de [H2F]+-SbF6–. Por ejemplo, el H(CHB11Cl11) tiene un APG determinado experimentalmente de 241 kcal/mol.
Manejo y seguridad
El HF-SbF5 es extremadamente corrosivo, tóxico y sensible a la humedad. Como la mayoría de los ácidos fuertes, el ácido fluoroantimónico puede reaccionar violentamente con el agua, debido a la hidratación exotérmica. Por consiguiente, no puede ser usado en solución acuosa, sólo en fluoruro de hidrógeno como disolvente.

El ácido fluoroantimónico no puede ser almacenado en vidrio, ya que lo disolverá. Debe almacenarse en un recipiente de PTFE (politetrafluoroetileno).
Para más información Fluoroantimonic acid
Como citar este artículo:
APA: (2020-08-04). Ácido fluoroantimónico. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/acido-fluoroantimonico/
ACS: . Ácido fluoroantimónico. https://quimicafacil.net/compuesto-de-la-semana/acido-fluoroantimonico/. Fecha de consulta 2024-04-16.
IEEE: , "Ácido fluoroantimónico," https://quimicafacil.net/compuesto-de-la-semana/acido-fluoroantimonico/, fecha de consulta 2024-04-16.
Vancouver: . Ácido fluoroantimónico. [Internet]. 2020-08-04 [citado 2024-04-16]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/acido-fluoroantimonico/.
MLA: . "Ácido fluoroantimónico." https://quimicafacil.net/compuesto-de-la-semana/acido-fluoroantimonico/. 2020-08-04. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net